Irgendwie hat es Kollagen geschafft, sich zumindest in der Sportler-Szene einen zweifelhaften Ruf zu machen. Schuld daran ist jedoch nicht Kollagen selbst, sondern mangelnde und oberflächliche Information die zu einem Thema verbreitet wurden.
ZEIT FÜR AUFKLÄRUNG!!
Die Inhalte in diesem Beitrag werden die Sichtweise auf Kollagen nicht nur leicht verändern, sondern einmal komplett umkrempeln – DAS ist ein Versprechen!
Viel Spaß
Wissenswerte Grundlagen zu Kollagen
Vorkommen, Aufbau und Funktion
Kollagen ist mit über 30% Anteil das am häufigsten vorkommende Protein im menschlichen Körper. Bindegewebe (Knochen, Sehnen, Bänder, Knorpel und Zähne) sowie Muskeln (61) und Haut setzen sich mitunter zu einem großen Teil aus Kollagen zusammen. Natürlich enthält auch Muskelgewebe Kollagen.
Als Auffälligkeit der Aminosäurefrequenz von Kollagen lässt sich einerseits der Hohe Gehalt an Glycin sowie eine häufig in Kollagen vorkommende Aminosäuresequenz aus Glycin-Prolin-Hydroxyprolin hervorheben. Zur körpereigenen Bildung von Kollagen werden neben Glycin, Prolin, Hydroxyprolin und Arginin zudem ausreichende Mengen Lysin (eine essentielle Aminosäure) sowie Vitamin C als Cofaktor benötigt (16).
Grundbaustein von Kollagen ist eine Peptidkette aus etwa 1050 Aminosäuren ist. Drei dieser Ketten lagern sich zu einer sog. Tripelhelix zusammen. Durch Verbindungen vieler dieser Gebilde entstehen Kollagenfibrillen, die durch Quervernetzung weiter stabilisiert werden und ein dreidimensionales Netzwerk erzeugen.
Dank der besonderen Struktur ist Kollagen beispielsweise verantwortlich für die Reißfestigkeit von Bändern und Sehnen, die Flexibilität von Knochen oder die Druckresistenz von Gelenkknorpeln.
Bestandteil des Bindegewebes
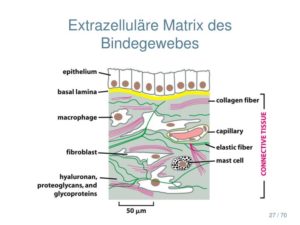
Bindegewebe besteht aus Zellen sowie Strukturen die diese miteinander verbinden. Verschiedene Fasertypen (kollagene Fasern, elastische Fasern und retikuläre Fasern) bilden zusammen mit der sog. Grundsubstanz eine gelartige Struktur, die bei tierischen Geweben die Räume zwischen den Zellen ausfüllt. Man bezeichnet diese Räume als extrazelluläre Matrix.
Bei der extrazellulären Matrix handelt es sich nicht um eine unstrukturierte Ansammlung von Makromolekülen im Zellzwischenraum, sondern um ein komplexes Konstrukt aus verschiedenen Fasern, die in eine Grundsubstanz eingebettet sind. Die Grundsubstanz setzt sich zusammen aus Wasser, verschiedenen Proteinen, Polysacchariden und etlichen weiteren Substanzen.
Aufbau der extrazellulären Matrix
Elastin (elastische Fasern), Hyaluronsäure (Proteoglykane und Glykosaminoglykane) und retikuläre Fasern sind neben Kollagen drei wichtige Bestandteile der extrazellulären Matrix.
- Elastin ist für die Dehnbarkeit und Verformbarkeit der Gesamtstruktur verantwortlich. Es kommt in großem Mengen in der Haut, Lunge aber auch in Blutgefäßen vor.
- Hyaluronsäure ist besonders für seine Eigenschaft bekannt große Mengen Wasser an sich zu binden. Es findet sich daher in großer Menge in Knorpelstrukturen, Bandscheiben, der Haut oder in Gelenkflüssigkeit (Synovia).
- Retikuläre Fasern bilden Netze um Einrichtungen wie Nervenfasern, Muskelfasern, Kapillaren sowie jede Zelle der glatten Muskulatur. Der Aufbau dieser Proteinarten unterscheidet sich von dem des Kollagens.
Aufgaben der extrazellulären Matrix
- Formgebung von Geweben und Organen
- Steuerung des Wassergehalts der Gewebe
- Elastizität der Gewebe
- Zugfestigkeit und Stabilität von Knochen, Sehnen und Bänder
- Zytokinreservoir (Proteine zur Zellbildung)
- Signaltransduktion in Geweben (Überführung einer Information von extra- zu intrazellulär)
- Verankerung und Polaritätsvorgabe für Zellen
- Beeinflussung von Wundheilungsprozessen
- Filterleistung der Niere aufgrund ihrer speziellen Basalmembranen
Fazit
Kollagen findet sich als am häufigsten im menschlichen Körper vorkommendes Protein im Bindegewebe, sowie in aktiven und passiven Bewegungsstrukturen. Durch seine besondere Struktur verleiht Kollagen zugleich Flexibilität und Stabilität.

Kollagen ist nicht gleich Kollagen
Kollagentypen
In den vielfältigen Geweben des tierischen/menschlichen Organismus finden sich unterschiedliche Kollagentypen, die sich in Ihrer Aminosäurezusammensetzung, der Molekülkettenlänge und dem Vernetzungsgrad der Molekülketten unterscheiden. Insgesamt weiß man derzeit von 28 verschiedenen Kollagentypen.
Das am häufigsten im Säugetier vorkommende Kollagen ist Kollagen Typ-I. Es findet sich in Haut, Muskelfaszien, Sehnen, Gefäßen, Knochen, Zähnen sowie inneren Organen und ist Hauptbestandteil bei der Herstellung von Kollagenprodukten. Kollagen Typ II fungiert als Strukturprotein für hyaline und elastische Knorpel. Kollagen Typ III kommt in inneren Organen, Gefäßwänden und Haut vor. Kollagen vom Typ IV und V sind Bestandteile der nur via Elektronenmikroskop sichtbaren Basallamina (Basalmembran). Gemische aus Kollagen Typ I und III kommen in Sehnen, Bändern und der Haut vor.
Kollagen – Nichts weiter als billiger, minderwertiger Schlachtabfall?!
Kollagen ist prinzipiell tierischer Herkunft. Kollagenreiches Gewebe wie Haut, Bindegewebe oder Knochen von Schweinen, Rindern sowie Geflügel aber auch Haut, Gräten und Flossen von Fischen können für seine Herstellung verwendet werden. Der Mythos Kollagen bestehe aus „Schlachtabfällen“ rührt von daher, dass wie gezeigt NICHT Fleisch für seine Herstellung verwendet wird, sondere andere tierische Bestandteile mit einem höheren Kollagenanteil. Letztlich werden jedoch auch diese Rohstoffe erst nach eingehender Kontrolle auf spezifische Qualitätsanforderungen (HACCP, ISO-Normen) vom Veterinäramt für den menschlichen Verzehr freigegeben, ebenso wie es bei anderen Lebensmitteln wie Fleisch der Fall ist.
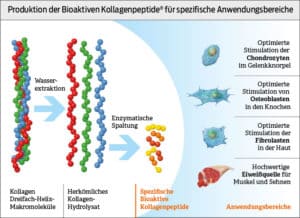
Kollagen, Kollagenhydrolysat und spezifische Bioaktive Kollagenpeptide®
Über den Herstellungsprozess lassen sich die grundlegenden Unterschiede verschiedener Darreichungsformen von Kollagen erschließen. Das Ausgangsmaterial für die Herstellung aller Kollagenprodukte wird gewaschen, homogenisiert und demineralisiert bevor durch Wasserextration Kollagen in Form von Gelatine erhalten bleibt. Der Vorgang der Hydrolyse sorgt nun weiter für die Herstellung von Kollagenhydrolysat welches sowohl sensorisch (Geschmack, Geruch und Löslichkeit) als auch hinsichtlich seiner Effekte nicht mehr mit Gelatine gleichgesetzt werden darf. Via enzymatischer Spaltung werden aus Kollagenhydrolistat weitere spezielle Peptidfraktionen gewonnen. Man nenn diese Peptidfraktionen auch spezifische Bioaktive Kollagenpeptide® (27-29).
Auch der Rohstoff entscheidet
Während man hinsichtlich der Effekte von Kollagen aus Rind und Schwein von vergleichbaren Effekten ausgehen kann, fällt die Wirksamkeit bei Kollagen aus Fisch dank unterschiedlicher Peptidzusammensetzung gänzlich anders aus (30,31).
Molekülgröße macht den Unterschied
Weitere wichtige Unterscheidungen bei Kollagenprodukten betreffen die Molekülgröße. Diese liegt bei Gelatine im Bereich von 100kDA liegt, während dank enzymatischer Hydrolyse Kollagenpeptide mit einem Molekulargewicht von 0,3 – 8 kDA entstehen. Aus dieser Eigenschaft ergeben sich letztlich gänzlich unterschiedliche Effekte ausgehend von Gelatine, Kollagenhydrolisat oder aber spezifischer, Bioaktive Kollagenpeptide®.
Während herkömmliches Kollagenhydrolysat noch mehr oder weniger unspezifisch alle Bestandteile von Kollagen enthält, werden bei spezifischen Bioaktive Kollagenpeptiden® gerade die Bindungen mit 3 bis 20 Aminosäuren abgespalten, die vorher in Studien besondere Effekte auf spezifische Gewebe gezeigt haben. Jeder Ausläufer spezifischer Bioaktive Kollagenpeptide® ist auf eine maximale Stimulierung verschiedener menschlicher Zelltypen konzipiert die an der Bildung von Kollagen beteiligt sind. Mit der Zufuhr spezifischer Bioaktive Kollagenpeptide® sorgt man damit einerseits für die Aufnahme typischer Kollagenaminosäuren und andererseits für die Stimulierung spezieller Zellen wie beispielsweise:
- Fibroblasten (Haut)
- Chondrozyten (Knorpel)
- Osteoblasten / Osteoklasten (Knochen)
- Muskelzellen
- Tendozyten / Ligamentozyten (Sehnen)
Warum nicht einfach Gelatine?
Kollagen ist bekannt als eigentlicher Rohstoff für die Herstellung von Gelatine. Gelatine ist die denaturierte Form von fibrillärem Kollagen Typ I, II oder III. Es gibt mehrere Gelatine-Arten (Typ A und Typ B) mit unterschiedlichen Eigenschaften und folglich auch Anwendungsgebieten. Das sehr niedrige Allergenpotenzial aber auch die hervorragende Wasserbindungskapazität von Gelatine machen sie zu einem wertvollen Inhaltsstoff für Lebensmittel aber auch pharmazeutische Produkte.
Nicht selten geht man davon aus, Gelatine sei wegen seiner Eigenschafen eine kostengünstige Alternative zu Kollagenhydrolsaten, allerdings gestaltet sich diese These als nicht haltbar (77).
Kollagenhydrolysate sind, wie bereits genannt, Produkte mit Peptiden mit niedrigem Molekulargewicht, oft zwischen 3 und 6 kDa. Zum Vergleich das Molekulargewicht von Gelatine wird mit etwa 100 kDa angegeben.
Der gesundheitliche Nutzen von Kollagenhydrolysaten wird vor allem dem Gehalt an bioaktiven Peptiden und den entsprechenden Sequenzen zugeschrieben. Zusätzlich zu ihren bioaktiven Peptiden enthalten Kollagenhydrolysate auch Aminosäuren, die zu ihrer Bioaktivität beitragen.
Das Vorhandensein von bioaktiven Peptiden, wie Pro-Hyp, Alanin (Ala)-Hyp, Pro-Hyp-Gly und Gly-Pro-Hyp, im Blut wurde nach dem oralen Verzehr von Kollagenhydrolysat und Gelatine in klinischen Studien am Menschen nachgewiesen. Die Absorption von Glycin, Prolin und Hydroxyprolin war nach dem oralen Verzehr von Kollagenhydrolysaten im Vergleich zu nicht-enzymatisch hydrolysiertem Kollagen (Gelatine) signifikant höher, was darauf hindeutet, dass verarbeitete Kollagenprodukte eine erhöhte Absorption und Bioverfügbarkeit haben.
Unabhängig vom Ausmaß der Verdauung ist die Bioaktivität von Kollagenhydrolysat abgeleiteten bioaktiven Peptiden und damit die klinische Wirksamkeit stark von ihrer Bioverfügbarkeit abhängig, d. h. von dem Anteil, der nach oraler Einnahme unverändert den systemischen Kreislauf erreicht.
Peptide mit großem Molekulargewicht werden weniger effektiv absorbiert als Peptide mit niedrigem Molekulargewicht, so dass Kollagenhydrolysate mit niedrigerem Molekulargewicht (0,3-6 kDa) eher absorbiert werden, um ihre Bioaktivität zu entfalten als dies bei höherem Molekulargewicht (100 kDa) zu erwarten ist.
Fazit
Das einzige das Gelatine, Kollagenhydrolysat und spezifische Bioaktive Kollagenpeptide® verbindet ist derselbe Rohstoff. Sie unterscheiden sich ansonsten gänzlich in deren Eigenschaften und Effekten. Als spezifisches Bioaktive Kollagenpeptid® ist es dieser fortschrittlichen Variante des Kollagens möglich, spezielle Zelltypen gezielt zu stimulieren.

Kollagenhydrolysat und spezifische Bioaktive Kollagenpeptide® für die Gelenke
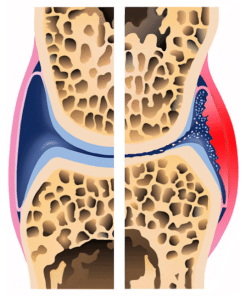
Gesund geboren, besitzen wir Menschen ebenso gesundes Knorpelgewebe, welches für die Beweglichkeit und Gesunderhaltung der Gelenke unerlässlich ist. Verletzungen, Überlastung, Fehlbelastungen, ein erhöhtes Aufkommen entzündlicher Prozesse oder übliche altersbedingte Degenerationsprozesse sorgen dafür, dass unsere Gelenke und hier insbesondere Knorpelgewebe in Mitleidenschaft gezogen werden. Während beim gesunden Knorpel ein Gleichgewicht zwischen auf- und abbauenden Vorgängen herrscht, überwiegen katabole (abbauende) Prozesse in einem der oben genannten Fälle. Das Resultat sind dann irgendwann Arthrose (Zerstörung der Knorpelschicht eines mit Gelenks mit damit einhergehenden Knochenveränderungen) bzw. Osteoarthrits (chronisch-degenerative Veränderungen der Gelenke) (3). Beigefügte Darstellung zeigt den Vergleich eines gesunden mit einem von Arthrose befallenen Gelenks.
*entnommen aus (4)
Während nach Martinez-Puig et al (71) keine biologische Funktion auf die Gelenkgesundheit für Gelatine beschrieben ist, gilt dies nicht für natives Kollagen oder hydrolysierte Kollagene. Beide üben für sich eigenständige Effekte aus.
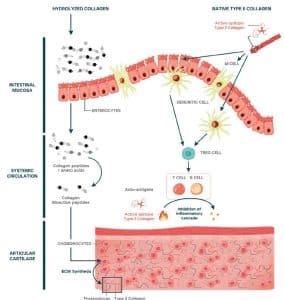
Natives Kollagen hat einen spezifischen, immunvermittelten Wirkungsmechanismus bekannt als orale Toleranz. Orale Toleranz wurde definiert als die aktive Unterdrückung von spezifischen Immunreaktionen auf Antigene, die zuerst im Magen-Darm-Trakt auftreten. Sie ist ein immunvermittelter Mechanismus zur Vermeidung von Immunreaktionen gegen harmlose Antigene, wie Nahrungsproteine oder kommensale Organismen. Der Mechanismus bedarf einer dreifachkettigen Kollagenstruktur und wirkt sich auch auf inflammatorische Vorgänge aus. Dies ist deshalb interessant, da man von OA weiß, dass diese neben mechanischen Faktoren auch durch Entzündungen ausgelöst wird (71).
Bei hydrolysiertem Kollagen geht es zentral um die Bioverfügbarkeit von Peptiden, die es über den Blutkreislauf bis ins Gelenkgewebe schaffen, wo sie sich anreichern. Hierfür hat sich ein niedriges Molekulargewicht als nützlich erwiesen, was wiederum den Link zu spezifischen Kollagenpeptiden herstellt. Im Knorpel angekommen entfalten Kollagenpeptide unterschiedliche biologische Wirkungen wie (71):
- die Synthese von Proteoglykanen und Kollagen Typ II
- die chondrogene Proliferation und Differenzierung
- eine vermehrte Aktivität von Osteoblasten
- eine verringerte Aktivität von Osteoklasten
Allesamt sind förderlich für die Knorpelreparatur.
Spezifische Bioaktive Kollagenpeptide® können dabei helfen ein Ungleichgewicht aus Abbau und Aufbau zu verändern in dem sie einerseits die für die Kollagenbildung wichtigen Aminosäuren Glycin, Prolin und Hydroxyprolin liefern und andererseits Knorpelzellen (Chondrozyten) zur Bildung von Kollagen und extrazellulärer Matrix anregen (5). Es existieren klinische Studien an Menschen (6) die in Verbindung mit der Aufnahme von 10g Kollagenhydrolysat bei Betroffenen mit leichter Knieosteoarthritis eine signifikante Zunahme des Proteoglykan-Gehalts (als Teil der extrazellulären Matrix) nach 24 Wochen nachweisen. Die statistische Signifikanz verlor sich jedoch binnen eines Zeitraumes von 48 Wochen wieder. Eine RC-Studie von Lugo et al (10) untersuchte Veränderungen der Symptomatik von Osteoarthritis mit einer Anwendung von 40mg Typ-II-Kollagen täglich über 6 Monate und stellte eine signifikante Verbesserung sowie gute Verträglichkeit fest. 2017 kamen Liu et al (7) in deren systematischem Review zu dem Schluss, dass Kollagenhydrolysat im Kurzzeitmodell und über mittlere Versuchszeiträume klinisch bedeutsam in der Lage ist die Schmerzsymptomatik bei Osteoarthritis zu verbessern. Im Langzeitmodell muss jedoch noch weiter geforscht werden, ebenso wie es weiterführend zu klären gilt, welche Unterschiede es macht, bestimmte Arten von Kollagenpeptiden anzuwenden.
.
*entnommen aus (7)
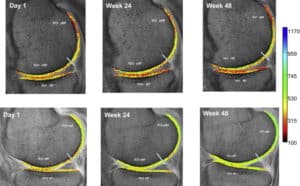
In der Studie von McAlindon et al (67) zeigten die Forscher via Magnetresonanztomographie und dem hierüber definierten sog. dGEMRIC-Index wie sich 10g bioaktive Kollagenpeptide bei leichter Form von Arthritis auswirken. Binnen 48 Wochen erhöhte sich besagter Index signifikant gegenüber einer ausbleibenden Verabreichung. dGEMRIC gibt Aufschluß über die Knorpelstruktur. Je höher desto kompakter! Oben in der Darstellung sieht man den Verlauf der Placebo-Gruppe, unten den Verlauf der Gruppte mit Verabreichung von bioaktiven Kollagenpeptiden,
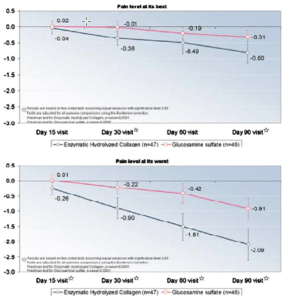
Im direkten Vergleich verabreichten Forscher 100 von Kniearthrose betroffenen Personen über 13 Wochen entweder 10g bioaktive Kollagenpeptide oder 1,5g Glucosamin-Sulfat. Wie beigefügte Darstellung zeigt gingen deutlichere Effekte in der Schmerzreduzierung (Pain Level) von der Verabreichung der Kollagenpeptide aus (66).
Eine Übersichtsarbeit von Khatri et al (76) befasste sich mit den Effekten von Kollagenpeptiden auf die Körperzusammensetzung, die Kollagensynthese, muskuläre Erholung sowie Gelenkgesundheit. Die Forscher stellen mit Dosierungen von 5 bis 15g pro Tag starke Effekte zur Verbesserung von Gelenkschmerzen und der Gelenkfunktionalität fest. Die Körperzusammensetzung veränderte sich bei älteren sarkopenischen Männern stärker als bei jüngeren Trainierenden. Zur Förderung der Kollagensynthese scheinen 15g pro Tag wirksamer zu sein als 5g pro Tag. Gefördert werden kann die Kollagensynthese mit der Verabreichung von Vitamin C sowie regelmäßiger Bewegung. Eine Einnahme vor sportlicher Betätigung sollte bevorzugt werden um die Kollagensynthese zu maximieren. Einflüsse einer Kollagensupplementierung auf Muskelerholung wurden als leicht aber signifikant beschrieben.
Bei Genc et al (79) konnten in einer randomisiert, doppelblind, Placebo kontrollierten Studie an 32 Probanden mit Meniskopathie binnen 8 Wochen unter Verwendung einer speziellen Formel aus Kollagenpeptiden, weiteren Gelenknährstoffen und Vitamin C signifikante Verbesserungen der Schmerzen, von Kraftwerten, des Auftretens von Kinesiophobie (Angst vor Schmerzen) sowie der Lebensqualität nachgewiesen werden. Für einige weitere durchgeführte Funktionstests reichte die Anwendungsdauer nicht für einen signifikanten Effekt aus.
Effekte bei Sportlern?
Auch hierzu wurde bereits geforscht (65). Im Rahmen eines 24-wöchigen Versuchs mit 147 aktiven Probanden war die Verabreichung von 10g zuzüglich Vitamin C aus der Hagebutte in der Lage, bestehende Gelenkschmerzen sowohl in Ruhe als auch unter Belastung merklich zu beeinflussen. „Bioaktive Kollagenpeptide gelangen in die Gelenke und stimulieren dort das Gelenkgewebe hin zu vermehrtem Aufbau der den Mehrverbrauch über Sport in der Lage ist zu kompensieren. Die lindere mitunter die Schmerzsymptomatik“ – so die Forscher.

Bei Zdzieblik et al (68) untersuchte die Effekte bei aktivitätsbedingten Gelenkschmerzen an jungen, aktiven Erwachsenen. Die Forscher verabreichten den 180 Probanden nach dem Zufallsprinzip entweder 5g Kollagenpeptide oder ein Placebo und stellten in der Supplementgruppe eine signifikante Reduktion der Schmerzsymptomatik fest die so in der Placebo-Gruppe nicht messbar war.
Wenngleich ein Claim für die Bezeichnung „Fördert die Gelenkgesundheit“ von der EFSA 2011 nicht genehmigt wurde (9), besitzen spezifische Bioaktive Kollagenpeptide® schon heute eine Zulassung als „diätetisches Lebensmittel für besondere medizinische Zwecke (bilanzierte Diäten)“ für welche eine Reihe von Anforderungen in Bezug auf den Mehrwert als Betroffener gegeben sein muss (8).
Fazit
Kollagenhydrolysat und spezifische Bioaktive Kollagenpeptide® unterstützen die körpereigene Bildung von Knorpelsubstanz. Sie liefern wichtige Baustoffe für den Knorpelaufbau sowie den Erhalt gesunder Gelenke. Weiterführende Studien müssen belegen, inwieweit Betroffene auch von einer dauerhaften Einnahme profitieren.
Kollagenhydrolysat und spezifische Bioaktive Kollagenpeptide® für junge Haut
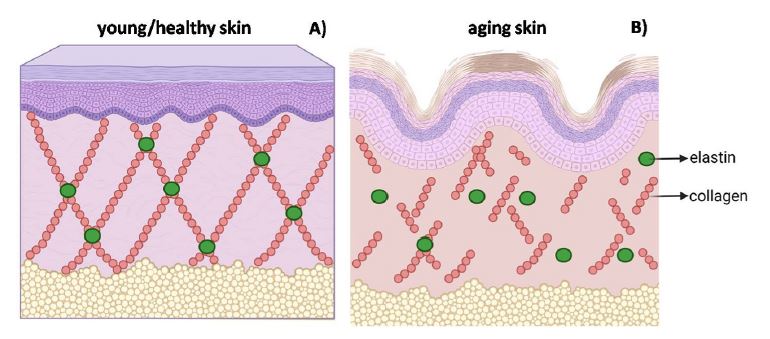
Auch von der Haut weiß man, dass diese zu 80% aus dem Strukturprotein Kollagen besteht. Ebenfalls ist bekannt, dass schon ab dem 25 Lebensjahr nicht nur die körpereigene Kollagenproduktion, sondern auch die dermale, extrazelluläre Matrix nachlässt, was sich über eine Abnahme der Hautdicke, Elastizität und Feuchtigkeit bemerkbar macht (15). Ein Kollagenverlust der Haut kann daneben genetische begründet sein oder über Faktoren wie Ernährung, Sonneneinstrahlung, Luftverschmutzung oder anstrengende Tätigkeiten beeinflusst werden.
Studien weisen die Aufnahme oral verabreichter spezifischer Bioaktive Kollagenpeptide® über den Verdauungstrakt weiter ins Blut bis in die Haut nach. Dort angekommen fördern sie einen signifikanten Anstieg von Procollagen Typ 1 (65%) sowie Elastin (18%) (12-14).
Im Tiermodell untersuchten Zague et al (1), inwieweit sich mit Kollagenhydrolysat der Hautstoffwechsel und in diesem Zusammenhang die Haut eigene Kollagenbildung beeinflussen lässt. Die Forscher berichten über eine reduzierte Aktivität des Enzyms MMP2 (erhöhte Aktivität lässt sich in gealterter Haut nachweisen) (2) sowie ein erhöhtes Aufkommen von Kollagen Typ I und IV was gleichzusetzen ist mit der Reduzierung von Alterungsprozessen durch Stimulierung aufbauender Prozesse der Haut. Die Verabreichung von Casein hatte im Vergleich eine weitaus geringere Wirkung.
Ohara et al (74) zeigen, dass die orale Verabreichung von Kollagenhydrolysaten (reich an Prolin und Hydroxyprolin) die Hyaluronsäure-Produktion in den dermalen Fibroblastenzellen stimuliert. Interessant erscheint dies, da Hyaluronsäure einerseits als Schlüsselmolekül für Hautfeuchtigkeit angesehen wird und andererseits, da bei alternder Haut ein Verlust von epidermaler Hyaluronsäure beobachtet wird.
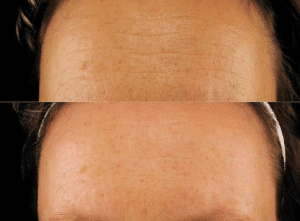
Schlippe et al (11) untersuchten die Verwendung spezifischer Bioaktive Kollagenpeptide® mit dem Namen ELASTEN (Kollagenpeptid-Gehalt 2,5g, plus Vitamin D, Biotin und Zink) über 3 Monate an 16 hautgesunden, weiblichen Probanden mit trockener Haut. Wie sich zeigte, konnten sowohl die Hautfeuchtigkeit (22%) als auch die Hautelastizität (20%) mit der Einnahme signifikant verbessert werden. Eine optische 3D-Messung der Haut bestätigte weniger Hautrauigkeit (17%) bereits nach 4 Wochen. Ein Teil der Verbesserungen ging binnen 4 Wochen nach der Einnahme des Produkts wieder zurück (3-5%), es blieben dennoch signifikante Verbesserungen bestehen.
*entnommen aus (11)
Zwei weitere Studien (17, 18) belegen mit der Einnahme spezifischer, Bioaktive Kollagenpeptide® einen erhöhten Kollagengehalt der Haut sowie einen Rückgang der Tiefe von Falten bereits nach 8 Wochen Einnahme. Bei Schwatz et al (19) kam es binnen 12 Wochen zu einer 76%-igen Verringerung der Hauttrockenheit sowie einem 13%-igen Rückgang der Faltentiefe. Die Forscher belegten in diesem Zusammenhang einen eindeutigen Anstieg des Kollagengehalts in der Haut. Etliche weitere Untersuchungen (20 – 23) deuten auf positive Effekte einer oralen Kollagensupplementierung auf die Hauteigenschaft hin. Nicht zuletzt konnte in Verbindung mit der Aufnahme von Kollagenhydrolysat bereits ein Rückgang des Grades an Cellulite beobachtet werden (24). Ebenso zeigen sowohl Gelatine (25) als auch Kollagen (26) zumindest im Tiermodell Haut schützende Effekte die in Verbindung mit Sonneneinstrahlung von Bedeutung sind.
In einer aktuellen Studie (64) vermochte die Verabreichung eines Komplex aus 2.5 g Kollagenpeptiden, Acerola Frucht Extrakt, Vitamin C, Zink, Biotin und nativem Vitamin E über 12 Wochen für deutliche besser Hauteigenschaften (improved skin hydration, elasticity, roughness, and density).
Eine Übersichtsarbeit von Dias Campus et al (72) schreibt dem Einsatz von Kollagenergänzungen Vorteile bei der Behandlung von Hautveränderungen zu, in dem sie
- Falten reduzieren
- Elastizität, Festigkeit sowie Hydration verbessern
- die Bildung von Poren verringern
- eine Schädigung durch die Sonne reduzieren
- die Kollagensynthesedichte der Haut erhöhen
Pu et al (73) führten eine systematische Übersichtsarbeit mit Meta Analyse zum Einfluss von Kollagenprodukten auf Hautalterung durch, in der 26 kontrollierte Studien mit 1721 Patienten involviert waren. Die Forscher kamen zu dem Ergebnis, dass eine Kollagensupplementierung die Hautfeuchtigkeit und Hautelastizität verbessern kann, insbesondere wenn die Einnahme über längere Zeit fortbesteht. Die Dosierungen in den involvierten Studien lagen zwischen 372mg und 10g. Ein relevanter Anteil der Studien wurde mit Kollagenpeptiden durchgeführt, der Rest mit hydrolysiertem Kollagen.
Fazit
Studien belegen neben einer guten Bioverfügbarkeit merkliche Effekte oraler Kollagenprodukte und insbesondere spezifischer Bioaktive Kollagenpeptide® für die Hautbeschaffenheit.

Spezifische Bioaktive Kollagenpeptide® für eine bessere Körperzusammensetzung
Schlechte Biologische Wertigkeit = Untauglichkeit für Sportler?
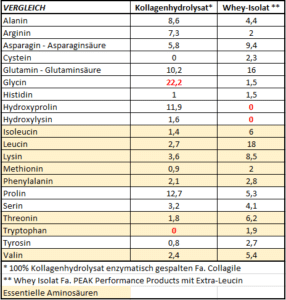
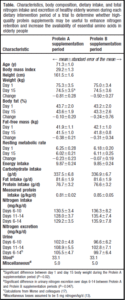
„Kollagen – Hör mir bloß damit auf, das ist minderwertiges Protein“?! Angesichts der bisher im Beitrag bereits vorgestellten Eigenschaften und Vorteile einer Verabreichung von Kollagenhydrolysat bzw. spezifischer Bioaktive Kollagenpeptide® wurde bereits klar, dass Aussagen wie diese bestenfalls von Halbwissenden nachgeplappert werden. Es bleibt dennoch interessant zu erfahren wie es dazu kommt. Ein Blick auf die Aminosäurebilanz offeriert einen möglichen Beweggrund.
Beigefügte Darstellung zeigt den Vergleich der Aminosäureverteilung einmal von Wheyprotein in seiner Form als Isolat (plus Leucin-Beigabe) und Kollagenhydrolysat wie es auch für die Herstellung spezifischer Bioaktive Kollagenpeptide® verwendet wird. Aus Studien wissen wir, dass gerade von Leucin ein starkes Proteinsynthese-Signal ausgeht. Wir wissen zudem, dass nur die essentiellen Aminosäuren eines Proteins in der richtigen Gewichtung darüber entscheiden wie gut sich dieses für den Aufbau körpereigenen Proteins eignet. Die Kennziffer für zweitgenannte Funktion nennt sich unter der gleichzeitigen Betrachtung der Resorption biologische Wertigkeit. Am Schaubild wird nun eindeutig ersichtlich, dass Kollagenhydrolysat generell viel weniger essentielle Aminosäuren liefert als Wheyprotein. Das KO-Kriterium für die biologische Wertigkeit ist jedoch die „rote Null“ bei einer der essentiellen Aminosäuren, nämlich bei Tryptophan. Genau diese „rote Null“ bescheinigt Kollagenhydrolysat eine biologische Wertigkeit von 0.
Merke
Würden wir uns ausschließlich von Kollagenhydrolysat ernähren, wäre Proteinaufbau aufgrund des fehlenden Tryptophans nicht möglich, da sie als essentielle Aminosäure vom Körper NICHT selbst hergestellt werden kann.
Schlechte biologische Wertigkeit und dennoch enorme Effekte
Fest steht, das zwischen 7 und 10% des Muskelgewebes aus Kollagen bestehen, wo es mitunter für die Muskel-Funktionalität von Bedeutung ist (61). Für Kollagenhydrolysat spricht zudem eine hervorragende Bioverfügbarkeit die sogar Wheyprotein in seiner Form als Konzentrat oder Isolat überlegen ist (52).
Ein zweiter Blick auf den Aminosäurevergleich zeigt, dass Kollagenhydrolysat zwei Komponenten liefert die sich so NICHT in Wheyprotein wiederfinden, nämlich Hydroxyprolin und Hydroxycholin. Kollagenhydrolysat enthält zudem einen außerordentlich hohen Anteil der Aminosäure Glycin. Diese Gegebenheit wird uns später noch beschäftigen.
Zwischenfazit
Kollagenhydrolysat weist eine gänzlich andere Aminosäurematrix auf wie man diese von hochwertigen Proteinquellen wie Molkenprotein kennt. Wie verhält sich diese Tatsache nun in der Praxis?

Das sagen Studien
Studie 1 – Spezifische Bioaktive Kollagenpeptide® + Krafttraining bei älteren Männern mit Sarkopenie
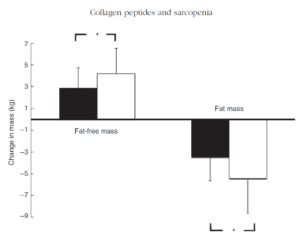
Die erste gut kontrollierte Studie (53) zu dieser Frage befasste sich mit den Effekten einer Verabreichung spezifischer Bioaktive Kollagenpeptide® an 53 älteren trainingsunerfahrenen Männern mit Sarkopenie (altersbedingtem Muskelschwund) der Klassen I und II. Alle Probanden führten zum Zeitpunkt der Studie, belegt durch Ernährungsprotokolle, bereits ausreichend Nahrungsprotein zu. Die Probanden absolvierten allesamt ein 12-wöchiges Trainingsprogramm mit 3 Trainingseinheiten pro Woche und erhielten hierzu entweder täglich 15g spezifische Bioaktive Kollagenpeptide® oder ein Placebo binnen 60 Minuten nach dem Training. Die Forscher bestimmten Unterschiede bei Fettmasse, fettfreier Masse und Knochenmasse vor und nach dem Versuch via DXA-Scan. Ebenfalls führen sie sensorische Tests sowie Leistungstests durch. Es zeigte sich bei allen Probanden eine durch Krafttraining ausgelöste Verbesserung bei fettfreier Masse, Fettmasse, Knochenmasse, Quadrizepsstärke und sensorischer Kontrolle. Signifikant ausgeprägtere Effekte stellten sich insbesondere bei der Körperzusammensetzung in der Kollagen-Gruppe ein wie beigefügte Darstellung zeigt:
Mit zusätzlicher Gabe spezifischer Bioaktive Kollagenpeptide® konnten positive Effekte eines 3-monatigen Krafttrainings bei Best-Agern mit Sarkopenie nochmals gesteigert werden, insbesondere in Sachen Veränderung der Körperzusammensetzung.
Studie 2 – Dosisfindung bei spezifischen Bioaktiven Kollagenpeptide®
Nachdem erste Effekte bei Best-Agern mit Sarkopenie festgestellt wurden, bestand die Aufgabe von Zdzieblik et al (45) darin heraus zu finden, welche Zufuhrmenge bei spezifischen Bioaktiven Kollagenpeptide® als „optimal“ angesehen werden kann. Sie testeten aus diesem Grund mehrere Dosierungen zusammen mit Krafttraining in Hinblick auf Veränderungen der Körperzusammensetzung an 105 gesunden, männlichen Probanden mittleren Alters (30 bis 60 Jahre). Die Teilnehmer führten hierzu über 12 Wochen 3x wöchentlich ein standardisiertes Krafttraining durch und erhielten täglich entweder 10, 15 oder 20g spezifischer Bioaktive Kollagenpeptide®. Veränderungen der Körperzusammensetzung wurden via DXA-Messung bestimmt.
Wie beigefügte Darstellung zeigt, stellte sich bei allen drei Gruppen eine enorme und statistisch signifikante Verbesserung der Körperzusammensetzung ein (MEHR fettfreie Masse und WENIGER Fettmasse). Ein dosisabhängiger Effekt wurde zwar festgestellt, jedoch nicht in signifikantem Ausmaß und doch erhöhte sich der Anteil an fettfreier Masse mit 15g spezifischer bioaktiver Kollagenpeptide um 19% mehr als in der Gruppe die nur 10g erhielt, während eine weitere Erhöhung auf 20g täglich nur noch eine Erhöhung von 2-6% erlaubte. Ähnlich verhielt es sich auch beim Rückgang von Fettmasse, weshalb die Forscher eine tägliche Einnahme von 15g spezifischer bioaktiver Kollagenpeptide als „optimale Dosierung“ ansehen.
15g spezifische Bioaktive Kollagenpeptide® genügen für maximierte Effekte auf die Körperzusammensetzung. Eine Erhöhung der Dosierung verspricht nicht automatisch zusätzliche Vorteile
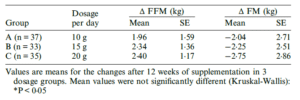
Studie 3 – Spezifische Bioaktive Kollagenpeptide® + Krafttraining bei gesunden Männern mittleren Alters
Oesser et al führten eine im ISSN-Protokoll aus 2017 (46) zitierte Studie mit 167 gesunden Männern im Alter von 30 bis 60 Jahren durch. Auch sie absolvierten über 12 Wochen, 3x wöchentlich ein standardisiertes Krafttraining über je 60 Minuten und erhielten hierzu entweder 10, 15, 20g spezifischer Bioaktive Kollagenpeptide® oder ein Placebo. Via DXA-Scan erhobene Daten zur Körperzusammensetzung zeigen einen statistisch signifikanten Anstieg bei fettfreier Masse mit Zufuhr von 15g spezifischer Bioaktive Kollagenpeptide® verglichen mit der Placebogruppe. In Zahlen ausgedrückt vermochte die Verabreichung spezifischer Bioaktive Kollagenpeptide® eine mehr als 80% stärkere Zunahme an Muskelmasse bei einem zusätzlichen Verlust an Fettmasse in Höhe von 1,8kg verglichen mit Placebo. Auch hier wurde wieder ein dosisabhängiger Effekt festgestellt der die Forscher dazu veranlasste die optimale Dosierung ein weiteres Mal auf täglich 15g festzulegen. (Bei fettfreier Masse d = 0,380 für 10 g BCP auf d = 0,433 für 15 g BCP und d = 0,510 / bei Fettmasse d = 0,402 (10 g BCB) auf d = 0,459 (20 g BCP))
Placebo-kontrolliert lässt sich mit spezifischen Bioaktiven Kollagenpeptide® der Effekt von Krafttraining auf die Körperzusammensetzung deutlich anheben

Studie 4 – Whey vs.Kollagenhydrolysat bei älteren Damen
Basierend auf der Annahme, dass eine Proteinaufnahme unter RDA einen Verlust an Muskelmasse fördert, dazu das Morbiditäts-Risiko erhöht (47,48) und selbst eine Versorgung nach RDA (0,8g/kg/kg) in Verbindung mit einer isokalorischen (bedarfsgerechten) Diät zu einem signifikanten Muskelabbau bei älteren Männer und Frauen führt (49) machten sich Hays et al (50) auf, um den Einfluss von Wheyprotein und Kollagenhydrolysat auf die Stickstoffbilanz sowie die Körperzusammensetzung bei 9 älteren Frauen (Alter 65 bis 85) zu vergleichen. Die Probandinnen erhielten in einer RC-Doppelblind Studie mit der Gesamtaufnahme von jeweils 0,8g Protein pro Kilogramm Körpergewicht je die Hälfte allen Proteins einmal über Wheyprotein-Isolat (PDSAAS 100) und ein weiteres Mal nach 15-tägiger Auswaschphase über Kollagenhydrolysat angereichert mit Tryptophan (PDSAAS 36). Sie ernährten sich ansonsten von hochwertigen Proteinquellen sowie kohlenhydratlastig (65% KH / 35% F im Nicht-Protein-Anteil). Die Forscher bestimmten die Körperzusammensetzung sowie die Stickstoffaufnahme und sammelten den 24-Stunden-Urin für die Bestimmung von Stickstoffausscheidungen. Wenngleich die Unterschiede insgesamt als statistisch nicht signifikant angesehen wurden, kam es dennoch bei Whey-Isolat zu einem etwas stärkeren Rückgang an Körpergewicht der sich nicht über eine gleichzeitige Abnahme von Fettmasse begründet. Die Whey-Gruppe wies zudem eine leicht ausgeprägtere Stickstoffausscheidung auf. Schon bei Gogeon (51) trat in Verbindung mit einer hypokalorischen Diät unter ausschließlicher Verabreichung von entweder einem Casein-Soja-Gemisch oder angereichertem Kollagenhydrolysat eine insgesamt negativere Stickstoffbilanz in der Casein-Soja-Gruppe auf.
*entnommen aus (50)
Trotz schlechterer Proteinbewertung nach PDCAAS vermochte Kollagenhydrolysat die Stickstoffbilanz verglichen mit Wheyprotein mindestens in gleichem Ausmaß zu erhalten sofern die limitierende Aminosäure Tryptophan additiv verabreicht wurde.
Fazit
Erste Studienergebnisse zur Verwendung spezifischer Bioaktiver Kollagenpeptide®berichten von außerordentlichen Effekten auf die Körperzusammensetzung sowohl bei Best-Agern mit Sarkopenie als auch bei gesunden Männern mittleren Alters. Die generell geringere Verfügbarkeit von EAA verglichen mit Wheyprotein führte bei Kollagenhydrolysat mit Tryptophan-Zusatz nicht automatisch zu einer verschlechterten Stickstoffbilanz.
Bioaktive Kollagenpeptide® und Körperzusammensetzung
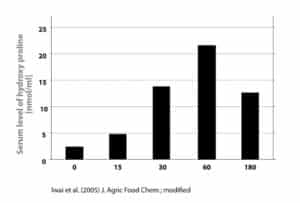
In einer neuen doppelblinden, randomisierten, placebokontrollierten Studie untersuchten die Forscher nun den Einfluss einer Verabreichung von entweder 15g bioaktiver Kollagenpeptide oder einem Placebo an 25 nicht-trainingserfahrenen Sportstudenten über 12 Wochen binnen 60 Minuten nach einem progressiv gestalteten Ganzkörpertraining welches 3x die Woche abgehalten wurde. Trainiert wurde im Bereich von 70%-1-RM mit je 2 Minuten Satzpause und 3 Arbeitssätzen pro Muskel und Training. Getestet wurden Kraftleistungen (1-RM-Tests) sowie Veränderungen der Körperzusammensetzung via BIA-Messungen. Es wurden außerdem Muskelbiopsien vor und während der Leistungs-Tests entnommen sowie Blutparameter vor und nach der Aufnahme des Supplements bestimmt um so die Hydroxyprolin-Konzentration im Blut zu messen.
Wie sich über die Blutprobe zeigte, erhöhte die Verabreichung bioaktiver Kollagenpeptide verglichen mit Placebo signifikant das Auskommen an Hydroprolin, ein Zeichen für die Effekte Aufnahme der Testergänzung. Insgesamt nahmen die Probanden nicht deutlich mehr oder weniger Gesamtkalorien und Makronährstoffen zu sich. In der Kontrollgruppe war die Aufnahme an Protein inkl. Kollagenpeptiden sogar leicht geringer (1,66g/kgkg) als in der Placebogruppe (1,86g/kgkg). Insgesamt kam es dennoch zu einem signifikant stärkeren Anstieg an Körpermasse gesamt, fettfreier Masse und auch bei Kraftleistungen zumindest in einer Disziplin in der Kollagenpeptid-Gruppe verglichen mit der Placebogruppe.
Die Forscher vermuten einen Einfluss von Kollagenergänzungen nicht auf die Muskelzelle selbst, sondern auf Strukturkomponenten welche die Muskelzelle umgeben. Untersuchungen von insgesamt 1377 Proteinen und Proteingruppen ergaben, dass insgesamt in etwa gleich viele im Rahmen der Trainingsphase eine Herabregulierung erfuhren. Während in der Placebogruppe durch Krafttraining 44 Protein eine Hochregulierung erfuhren, wurden in der Kollagenpeptidgruppe 221 Proteine stimuliert. Eine genauere Analyse zeigt, dass etliche dieser Proteine in Verbindung mit der Aktivität kontraktiler Fasern stehen. Auch zeigten sich Anpassungen der extrazellulären Matrix welches sich um die Muskelzellen findet, hier allerdings auch ohne eine entsprechende Ergänzung von Kollagenpeptiden als Reaktion auf die mechanische Belastung. Insgesamt unterschied sich die Proteinreaktion erheblich danach, ob nur trainiert wurde oder ob zum Training bioaktive Kollagenpeptide verwendet wurden. Die Forscher halten den hohen Gehalt an Hydroxyprolin für den potenziellen Auslöser der vermehrten Reaktion.
Fazit
Nicht nur an Betroffenen von Sarkopenie, sondern auch an jungen Trainierenden vermitteln Bioaktive Kollagenpeptide® Effekte die so mit Krafttraining alleine nicht zu verwirklichen sind

Bioaktive Kollagenpeptide® und Milchproteine
Meta-Analysen von renommierten Proteinforschern wie Luc van Loon (59,60) zeigen, dass der tägliche Einsatz von 6-106g bzw. 35-88g – Ø ca. 42g an Milchproteinen zu einer signifikanten Steigerung der fettfreien Körpermasse (FFM) führt. Die Ergebnisse liegen bei jüngeren Probanden im Bereich von bis zu 0,8 Kilogramm Zugewinn an FFM im Vergleich zu Placebo. Zdzieblik et al (69) untersuchten erstmalig im direkten Vergleich die Effekte von entweder 15g bioaktiven Kollagenpeptiden, der selben Menge Wheyprotein oder einem Placebo auf Körperzusammensetzung und Kraftwerte an 79 untrainierten Männern in Verbindung mit einem 12-wöchigen Krafttrainingsprotokoll. Die Probanden trainierten 3x wöchentlich für jeweils 60 Minuten. Wie sich zeigte erfuhren alle 3 Gruppen einen signifikanten Kraftzuwachs der sich über das Krafttraining begründet. auf Seiten fettfreier Masse wurde der stärkste und auch signifikante stärkere Effekt verglichen mit Placebo unter der Verabreichung von bioaktiven Kollagenpeptiden festgestellt. Der Effekt trat mit 1,6kg mehr fettfreier Masse sogar stärker auf als mit der Verabreichung von Wheyprotein welches für 0,5kg mehr fettfreie Masse sorgte. Die Forscher sehen auf Seiten von Kollagenpeptiden den Gehalt an Glycin, den hohen Gehalt an Kollagen in Skelettmuskulatur, sowie eine Stimulierung des Integrin-Rezeptors als maßgeblich effektiv an. Dass Wheyprotein trotz seines hohen Gehalts an mTOR stimulierenden Aminosäuren nicht mindestens dieselben Ergebnisse zeigen konnte führten die Forscher mitunter auf die Verwendung einer suboptimalen Menge von 15g zurück.
Fazit
Erste Studien vergleichen die Effekte von bioaktiven Kollagenpeptiden und Wheyprotein auf Muskelkraft und Körperzusammensetzung. Die Ergebnisse sind beeindruckend, allerdings sind weitere Untersuchungen erforderlich um den Stellenwert von bioaktiven Kollagenpeptiden für diese Zielsetzungen zu verdeutlichen.

Wie schaffen Kollagenhydrolysat bzw. spezifische Bioaktive Kollagenpeptide® das?
Die Effekte sind herausragend, weshalb der kritische Leser sich nun sicher die Frage stellt wie das alles möglich sein kann. Exakt lässt es sich zum aktuellen Zeitpunkt noch nicht beantworten. Das Forscherteam um Zdzieblik (53) äußert mehrere Erklärungsversuche wie es spezifische Bioaktive Kollagenpeptide® schaffen die Körperzusammensetzung derart positiv zu beeinflussen.
- Es steht eine verglichen mit Molkenprotein oder anderen Proteinformen erhöhte Verdaulichkeit dank niedrigem Molekulargewicht der Aminosäuren im Raum. Dies zusammen mit einer besseren Resorption könnte Muskelaufbau gezielt nach dem Training stärker gefördert haben (32,33).
- Diskutiert wird eine verbesserte körpereigene Creatinsynthese, da sich in Kollagen die hierfür benötigten Aminosäuren Arginin und Glycin in hoher Dosierung wiederfinden. Über ein höheres Aufkommen an Creatin könnte sich ein muskelanaboler Effekt begründen der in Studien zumindest teilweise gezeigt werden kann (34), für den aber noch kein feststehender Claim vorliegt.
- Der hohe Gehalt an Glycin stellt einen eigenständigen Faktor für eine verbesserte Körperzusammensetzung dar. Meléndez-Hevia (35) bezeichnen Glycin als semi-essentielle Aminosäure deren täglicher Bedarf von ca. 10g nur selten und auch nicht über eine High-Protein-Ernährungsweise gedeckt werden kann. Die ungewöhnliche hohe Glycin-Menge in Kollagenhydrolysat könnte einen Vorteil bedeuten, da von Glycin bekannt ist, dass es die Schlafqualität verbessert (44), die Ausschüttung von Wachstumshormon induziert (35) und die Freisetzung von GLP-1 erhöht. Letztgenanntes kann sich wiederum positiv auf das Blutzucker- und Insulinmanagement des Körpers auswirken mit der Folge einer erhöhten Freisetzung von Fettsäuren aus der Leber, einer erhöhten Fettsäureoxidation und damit letztlich einem positiven Effekt auf die Körperzusammensetzung (36-38).
- Auch eine verglichen mit anderen Proteinquellen stärkere Auswirkung auf die Mikrozirkulation und damit anabole Effekt auf die Muskulatur steht als potenzieller Mechanismus zur Diskussion (39,40).
- Gerade bei Best-Agern mit Osteoarthritis konnte ein reduziertes Schmerzaufkommen mit der Aufnahme von Kollagenhydrolysat gezeigt werden. Dies könnte dazu führen, dass Krafttraining mit mehr Trainingsgewicht/Intensität/Volumen absolviert werden kann und sich so weitere Vorteile verglichen mit Krafttraining ohne Kollagenhydrolysat ergeben (41,42).
- Studien an Zellkulturen deuten auf einen statistisch signifikanten Anstieg von mTOR und AMPK hin, der sogar dem von Wheyprotein überlegen ist (13% zu 30%). Auch die pax7-Expression als Hinweis auf die Bildung von positiven Satellitenzellen kann durch spezifische Bioaktive Kollagenpeptide® nachweislich erhöht werden, ebenso wie man spezifischen Bioaktive Kollagenpeptide® bereits eine bessere Kollagen-Biosynthese verglichen mit Wheyprotein unterstellen kann.
- Wenngleich die Theorie dahinter wissenschaftlich immer wieder in Frage gestellt wird (55-58), fällt der sog. PRAL-Index (er legt eine potenzielle Säurebelastung der Nieren fest) bei Eiprotein, Wheyprotein oder Casein verglichen mit derselben Menge spezifischer Bioaktive Kollagenpeptide® deutlich höher aus.
- Etwa 10% der Skelettmuskelmasse setzen sich in Form von Bindegewebe aus Kollagen zusammen. Hierüber werden ca. 30% aller Muskelkraft erzeugt (54).
Fazit
Wenngleich der genaue Mechanismus noch nicht ergründet ist hält die Wissenschaft eine Reihe von Theorien bereit, die allesamt den merklichen Effekt von spezifischen Bioaktive Kollagenpeptide® auf die Körperzusammensetzung unterstützen der sogar dem von Wheyprotein überlegen sein könnte. Anzunehmen ist Multikausalität.

Spezifische Bioaktive Kollagenpeptide® für Sehnen und Bänder
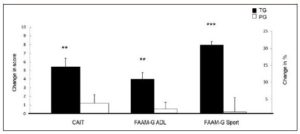
Sportartübergreifend ist neben leistungsfähigen Muskeln, einer guten Körperzusammensetzung und gesunden Gelenken auch ein stabiler Sehnen- und Bandapparat von Bedeutung. Der hohe Anteil an Kollagen auch in diesen Strukturen ist für die Festigkeit und gleichzeitig Elastizität verantwortlich. Gleichzeitig ist Kollagen für die mechanischen Eigenschaften des Bindegewebes unabdingbar. Aus der Studie von Schnuck und Oesser (62) geht hervor, dass sich spezifische Bioaktive Kollagenpeptide® in vitro stimulierend auf die Biosynthese extrazellulärer Matrixmoleküle in Sehnen und Bandzellen auswirken. Um potenzielle präventive und akute Effekte von 5g spezifischer Bioaktiver Kollagenpeptide® täglich auch am Menschen zu belegen untersuchten Dressler et al (63) einen Einfluss auf bestehende chronische Sprunggelenkinstabilität, verglichen mit Placebo (5g Maltodextrin/Tag), an 50 aktiven Männern und Frauen über 6 Monate. Bewertet wurden die jeweiligen Veränderungen mit:
- CAIT (Cumberland Ankle Instability Tool) – Fragebogen
- FAAM-G-ADL (Messung am Sprunggelenk im Alltag) – Fragebogen
- FAAM-G-Sport (Messung am Sprunggelenk bei sportlicher Betätigung) – Fragebogen
Aus allen 3 Erhebungen ging ein signifikant positiver Effekt auf die Knöchelstabilität mit Einnahme von 5g spezifischer Bioaktiver Kollagenpeptide® verglichen mit Placebo hervor. Die Probanden litten weniger unter Schmerzen und Schwellungen. Außerdem zeigte sich eine verbesserte Gewebsreparatur, während die Rückmeldungen in der Placebogruppe nahezu unverändert ausfielen.
Studie – Einfluss von Kollagenpeptiden auf Sehneneigenschaften mit Krafttraining
Jerger et al (70) untersuchten den Einfluss einer Verabreichung spezifischer Kollagenpeptide verglichen mit Placebo und in Zusammenhang mit Krafttraining auf die Beschaffenheit der Achillessehne von 40 jungen gesunden Probanden über 14 Wochen. Die Supplement-Gruppe nahm täglich 5g spezifischer Kollagenpeptide zu sich, die Kontrollgruppe ein Placebo. Wie sich zeigte, erhöhte die Supplementierung signifikant die Sehnenstärke verglichen mit Placebo ohne zusätzlichen Effekt auf die Sehnensteifigkeit. Die Forscher sehen in den Ergebnissen eine große Chance zur Vorbeugung oder bei der Behandlung von Sehnenüberlastung, da ein erhöhter Sehnenquerschnitt einer Abnahme der Sehnenbelastung gleich kommt.
In einer Folgestudie mit 50 gesunden, trainierenden Probanden über 14 Wochen stellten Jerger et al (75) erneut erhöhte Hypertrophie der Patellasehne in Verbindung mit einem hochbelasteten Widerstandstraining fest, wenn zum Training 5g spezifische Kollagenpeptide supplementiert wurden. Die erhöhte Querschnittsfläche resultiert aus einer stimulierenden Wirkung von Kollagenpeptiden auf die Kollagensynthese. Die Forscher vermuten das diese Effekte die Sehnenbelastung verringern und die Sehnenheilung unterstützen können.
Boldt et al (78) untersuchten die Effekte einer Kombination aus spezifischer Bewegung und Kollagenergänzung auf strukturelle und mechanische Eigenschaften der Achillessehne. Wie sich zeigte, hat diese einen Einfluss auf die Schmerzlinderung, die Querschnittsfläche sowie die Sehnendicke, möglicherweise aber nur einen geringen Einfluss auf Sehnensteifigkeit und Mikrovaskularität im direktem Vergleich mit alleinigem Training.
Fazit
Erste Humanstudien belegen bereits akute Effekte spezifischer Bioaktiver Kollagenpeptide® auf die subjektiv wahrgenommene Funktion des Sprunggelenks als funktionelle Einheit aus Gelenk, Sehnen und Bändern an chronisch von Instabilität betroffenen Sportlern. Auch zur Beschaffenheit von Sehnen bestehen bereits konkrete Daten.

Spezifische Bioaktive Kollagenpeptide® in der Praxis
Richtige Anwendung
Kommen wir nun zur praktischen Anwendung spezifischer Bioaktiver Kollagenpeptide®. Fest steht, dass die Verabreichung als spezifische Bioaktive Kollagenpeptide® die fortschrittlichste und beste Darreichungsform unter allen Kollagenprodukten darstellt, da hiermit die Zellen spezieller Zielgewebe stimuliert werden können.
Nach derzeitigem Kenntnisstand kann die Zufuhr einer wirksamen Menge spezifischer Bioaktive Kollagenpeptide® (die sich im Bereich von 5 bis 15g pro Tag bewegt) dieselbe Menge Nahrungsprotein ersetzen. Studien belegen einen mit hochwertigem Protein vergleichbaren Effekt auf die Stickstoffbilanz (sofern zusätzlich Tryptophan verabreicht wird). Zeitgleich ist bei nur 5 bis 15g täglich anzunehmen, dass die Versorgung mit allen essentiellen Aminosäuren (auch Tryptophan) aus sonstigen Proteinquellen des Tages gewährleistet werden kann. Optimal erscheint die Aufnahme binnen 60 Minuten nach sportlicher Aktivität mit einer anderen hochwertigen Proteinquelle. Wer dennoch seine Tryptophan-Versorgung gefährdet sieht, hat die Möglichkeit spezifische Bioaktive Kollagenpeptide® entweder additiv zu Nahrungsprotein einzunehmen, oder diese analog oben genannter Studie mit Tryptophan zu versehen. In jedem Falle fließen Kollagen und damit auch spezifische Bioaktive Kollagenpeptide® in die Proteinbilanz ein.
Fazit
Die Zufuhr von 1x täglich 15g spezifischer Bioaktiver Kollagenpeptide® stellt nach Sichtung aller verfügbarer Informationen die beste Einnahmeempfehlung eines Kollagenprodukts für akute und präventive Effekte bei Sportlern dar.
Resümee
Der heutige Beitrag stellt den Begriff „Kollagen“ in einem völlig neuen Licht dar. Mit seiner Verabreichung offenbaren sich Effekte die sich viele nicht im Traum erwartet haben. Neben herkömmlicher Gelatine stellen Kollagenhydrolysat und insbesondere spezifische Bioaktive Kollagenpeptide® Weiterentwicklungen dar an denen unaufhörlich geforscht wird. Während Effekte für die Gelenkgesundheit bereits weitläufig bekannt sind und sich Kollagen auch in Produkten für die Haut bereits häufig wiederfindet, stellt der Ansatz der Verwendung spezifischer Bioaktiver Kollagenpeptide® zur Verbesserung der Körperzusammensetzung oder für die Beschaffenheit von Sehnen und Bädern noch eine Neuheit dar. Das was man bereits weiß und dass was bereits zu spezifischen Bioaktiven Kollagenpeptide® an Untersuchungsergebnissen in den Startlöchern steht ist interessant genug um allen Leserinnen und Lesern von Body-Coaches.de einen Selbstversuch nahe zu legen, sowie Augen als auch Ohren zu diesem Thema weiter offen zu halten.
Bei Fragen zu passenden Angeboten für Bioaktive Kollagenpeptide® wendet Euch gerne an uns!
Sportlicher Gruß
Holger Gugg
———————————–
Quellen
(1)
https://www.ncbi.nlm.nih.gov/pubmed/21480801
(2)
Buch Dermatokosmetik – Maratoina Kescher
(3)
https://www.ncbi.nlm.nih.gov/pubmed/23830938
(4)
http://bioaktive-kollagenpeptide.de/wirkungen-gelenke/
(5)
https://www.ncbi.nlm.nih.gov/pubmed/17076983
(6)
https://www.ncbi.nlm.nih.gov/pubmed/21251991
(7)
http://bjsm.bmj.com/content/52/3/167.long
(8)
(9)
https://www.efsa.europa.eu/de/efsajournal/pub/2291
(10)
http://www.ncbi.nlm.nih.gov/pubmed/26822714
(11)
https://www.thieme-connect.com/products/ejournals/abstract/10.1055/s-0034-1393066
(12)
https://www.ncbi.nlm.nih.gov/pubmed/17253720
(13)
https://www.ncbi.nlm.nih.gov/pubmed/16076145
(14)
https://www.ncbi.nlm.nih.gov/pubmed/10498764
(15)
https://www.ncbi.nlm.nih.gov/pubmed/17540135
(16)
https://www.sciencedirect.com/science/article/pii/S0006291X0900518X
(17)
https://www.ncbi.nlm.nih.gov/pubmed/23949208
(18)
https://www.ncbi.nlm.nih.gov/pubmed/24401291
(19)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3426261/
(20)
https://www.karger.com/article/Abstract/351376
(21)
https://www.karger.com/Article/Abstract/464470
(22)
https://koreamed.org/SearchBasic.php?RID=0106KJCN/2008.13.6.912&DT=1
(23)
https://koreamed.org/SearchBasic.php?RID=0106KJCN/2008.13.6.912&DT=1
(24)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4685482/
(25)
https://www.sciencedirect.com/science/article/pii/S0308814609000387
(26)
http://onlinelibrary.wiley.com/doi/10.1111/j.1750-3841.2009.01236.x/full
(27)
http://www.mdpi.com/2304-8158/6/5/32
(28)
https://www.sciencedirect.com/science/article/pii/S0268005X11000427
(29)
(30)
https://www.ncbi.nlm.nih.gov/pubmed/24852756
(31)
https://www.ncbi.nlm.nih.gov/pubmed/19623200
(32)
https://www.ncbi.nlm.nih.gov/pubmed/10498764
(33)
https://www.ncbi.nlm.nih.gov/pubmed/19961355
(34)
https://www.ncbi.nlm.nih.gov/pubmed/23919405
(35)
https://www.ncbi.nlm.nih.gov/pubmed/20093739
(36)
https://academic.oup.com/ajcn/article/76/6/1302/4689577
(37)
https://www.ncbi.nlm.nih.gov/pubmed/15331379
(38)
https://www.ncbi.nlm.nih.gov/pubmed/11294496
(39)
https://www.ncbi.nlm.nih.gov/pubmed/9178551
(40)
https://www.ncbi.nlm.nih.gov/pubmed/23563560
(41)
https://www.ncbi.nlm.nih.gov/pubmed/17076983
(42)
https://www.ncbi.nlm.nih.gov/pubmed/11071580
(43)
https://www.ncbi.nlm.nih.gov/pubmed/20093739
(44)
https://www.ncbi.nlm.nih.gov/pubmed/22293292
(45)
(46)
(47)
https://www.ncbi.nlm.nih.gov/pubmed/7598065
(48)
https://www.ncbi.nlm.nih.gov/pubmed/16389253
(49)
https://www.ncbi.nlm.nih.gov/pubmed/11382798
(50)
https://www.ncbi.nlm.nih.gov/pubmed/19465192
(51)
https://www.ncbi.nlm.nih.gov/pubmed/1335970
(52)
https://www.ncbi.nlm.nih.gov/pubmed/16076145
(53)
https://www.ncbi.nlm.nih.gov/pubmed/26353786
(54)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3177172/
(55)
https://www.ncbi.nlm.nih.gov/pubmed/25863769
(56)
https://www.ncbi.nlm.nih.gov/pubmed/25837215
(57)
(58)
https://www.ncbi.nlm.nih.gov/pubmed/7797810
(59)
https://www.ncbi.nlm.nih.gov/pubmed/23134885
(60)
https://www.ncbi.nlm.nih.gov/pubmed/24724774
(61)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3177172/
(62)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4045593/
(63)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5950747/
(64)
https://www.ncbi.nlm.nih.gov/pubmed/31627309
(65)
https://pubmed.ncbi.nlm.nih.gov/18416885/
(66)
https://pubmed.ncbi.nlm.nih.gov/20401752/
(67)
https://pubmed.ncbi.nlm.nih.gov/21251991/
(68)
https://www.mdpi.com/2072-6643/13/2/523
(69)
https://www.mdpi.com/1660-4601/18/9/4837
(70)
https://pubmed.ncbi.nlm.nih.gov/35403756/
(71)
https://www.mdpi.com/2072-6643/15/6/1332
(72)
https://pubmed.ncbi.nlm.nih.gov/37064452/
(73)
https://www.mdpi.com/2072-6643/15/9/2080
(74)
https://pubmed.ncbi.nlm.nih.gov/20944430/
(75)
https://www.tandfonline.com/doi/full/10.1080/17461391.2023.2232758
(76)
https://link.springer.com/article/10.1007/s00726-021-03072-x
(77)
https://pubmed.ncbi.nlm.nih.gov/37064452/
(78)
https://journals.humankinetics.com/view/journals/jsr/aop/article-10.1123-jsr.2023-0115/article-10.1123-jsr.2023-0115.xml
(79)
https://bmcmusculoskeletdisord.biomedcentral.com/articles/10.1186/s12891-024-08244-w
Bildquellen
https://www.slideserve.com/kordell/zell-adh-sion-extrazellul-re-matrix
https://pixabay.com/de/gesicht-frau-sch%C3%B6nheit-1146038/
https://pxhere.com/de/photo/831227