Schon seit Jahrzehnten ist man sich im Klaren darüber, dass die Aufnahme von Aminosäuren aus Nahrungsprotein die Muskelproteinsynthese stimuliert. Das Ausmaß der Proteinsynthese-Reaktion auf eine Proteingabe ist von einer Reihe an Faktoren abhängig:
- Verfügbarkeit von essentiellen Aminosäuren
- Verdauung von Nahrungsprotein
- Aminosäureabsorption (Aufnahme vom Verdauungstrakt ins Blut)
- Skelettmuskeldurchblutung
- Aminosäurezusammensetzung
- Aufkommen an Anti-Nährstoffen
Der postprandiale Anstieg (nach einer Mahlzeit) der Konzentration an essentiellen Aminosäuren (EAA) im Blut gilt als Gradmesser für den Anstieg der Muskelproteinsyntheserate. Unterschiedliche Reaktionen der Muskelproteinsynthese in Verbindung mit der Aufnahme unterschiedlicher Proteinquellen begründen sich über:
- unterschiedliche Menge essentieller Aminosäuren pro Lebensmittel
- unterschiedliche Mengen enthaltenem Leucin pro Gabe
- eine unterschiedliche Gewichtung der essentiellen Aminosäuren zueinander
Bisher wurde in zahlreichen Studien insbesondere bei Milchprodukten ein rasanter Anstieg der Konzentration an essentiellen Aminosäuren im Blut nachgewiesen. Ebenso geht aus bestehenden Studien hervor, dass die Reaktion auf pflanzliche Proteine wie Sojaprotein, Reis oder Weizenprotein in weitaus geringerem Ausmaß stattfindet. Man geht davon aus, dass insgesamt weniger essentielle Aminosäuren und/oder ein Mangel an spezifischen Aminosäuren wie Leucin, Lysin oder Methionin an dieser Beobachtung Schuld hat. Bis dato mangelt es an verfügbarer Literatur die sich mit anabolen Eigenschaften pflanzlicher Proteinquellen befasst hat. In einem aktuellen Review (1) wurden nun frei erhältliche pflanzliche Protein-Isolate mit tierischen Protein-Isolaten verglichen.
Eine sehr spannende Arbeit mit ebenso spannenden Ergebnissen!

Involvierte Proteinquellen
In die Studie wurden mehrere Proteinquellen involviert von denen man weiß, dass diese als isolierte Proteinkonzentrate zur Ergänzung menschlicher und/oder tierischer Nahrung erhältlich sind.
Auf Seiten pflanzlicher Proteinquellen
- Hafer
- Lupine
- Weizen
- Hanf
- Mikroalgen
- Soja
- Brauner Reis
- Erbse
- Mais
- Kartoffel
Auf Seiten tierischer Proteinquellen
- Molkenprotein
- Milchprotein
- Kaseinat
- Casein
- Eiprotein
- Menschliche Muskelprotein-Aminosäure-Konstellation
Fazit
Die Studie vergleicht die jeweils aus dem Ausgangslebensmittel hergestellten isolierten Proteinkonzentrate einer Reihe von tierischen und pflanzlichen Lebensmiteln.
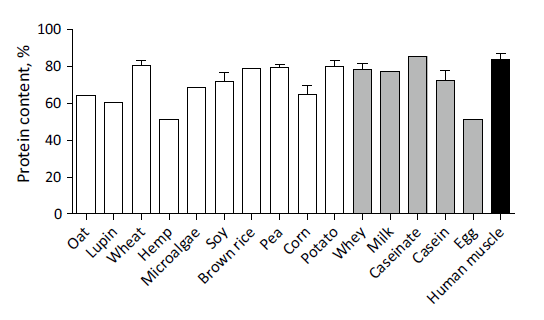
Proteingehalt in Vergleich
Beigefügte Darstellung zeigt den Gesamtproteingehalt pro 100g Ausgangsmaterial als isoliertes Proteinpulver und vergleicht dies mit der Menge enthaltenen Proteins in menschlichem Skelettmuskelgewebe.
Auf Seiten pflanzlicher Proteine:
• Hanf 51%
• Lupine 61%
• Hafer 64%
• Mais 65% (Range 58-75)
• Brauner Reis 79%
• Erbse 80% (Range 77-81)
• Kartoffel 80% (Range 77-83)
• Weizen 81% (Range 74-88)
• Soja 76% (Range 61-99)
Auf Seiten tierischer Proteine:
• Ei 51%
• Molkenprotein 78% (Range 72-84)
• Kalziumkaseinat 86%
• Casein 72,5% (Range 67-78)
• Menschliches Muskelgewebe 84%
Fazit
Die Darstellung zeigt eine große Spannweite enthaltener Proteinmengen pro 100g Konzentrat. Sowohl bei tierischen als auch bei pflanzlichen Quellen finden sich Vertreter mit hohen oder niedrigerem Gehalt.
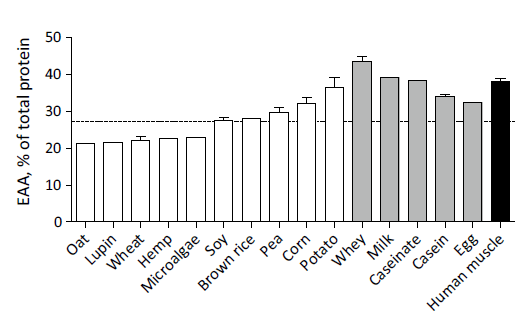
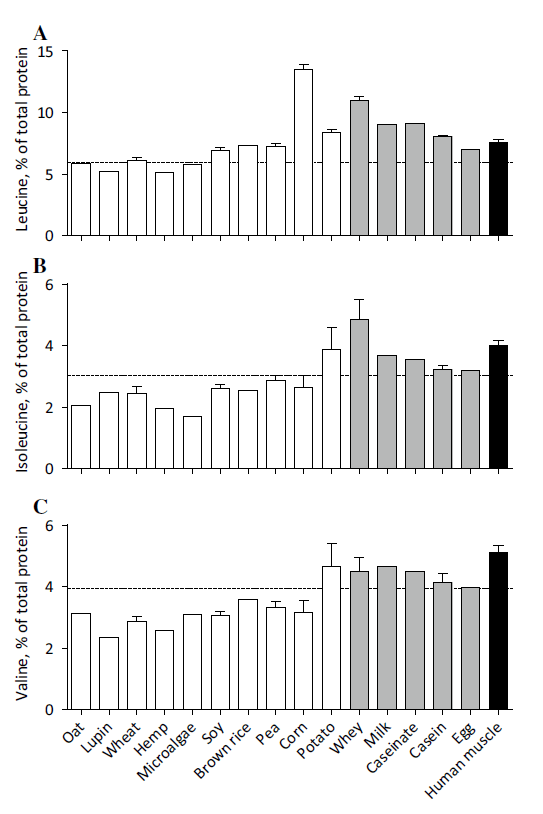
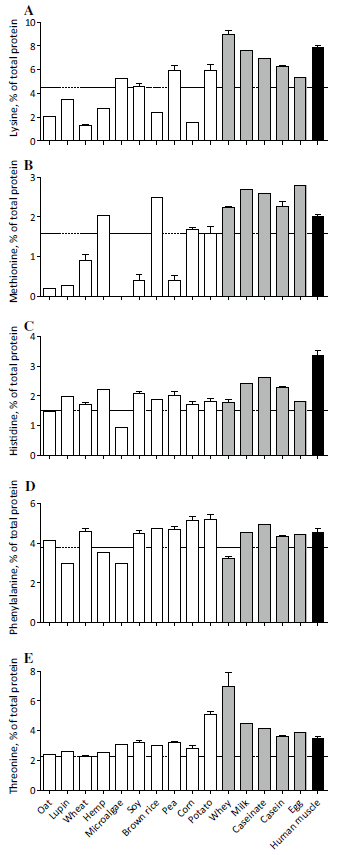
Gehalt essentieller Aminosäuren in Vergleich
Beigefügte Darstellung zeigt den Gehalt essentieller Aminosäuren in den jeweiligen Proteinkonzentraten. Die ebenfalls essentielle Aminosäure Tryptophan wurde nicht ausgewertet:
• Histidin
• Isoleucin
• Leucin
• Lysin
• Methionin
• Phenylalanin
• Threonin
• Valin
Auf Seiten pflanzlicher Proteine:
- Hanf 23%*
- Lupine 21%*
- Hafer 21%*
- Mikroalgen 23%*
- Mais 32%
- Brauner Reis 28%
- Erbse 30%
- Kartoffel 37%
- Weizen 22%*
- Soja 27%
*Die Mengen an essentiellen Aminosäuren in Hafer, Lupine, Weizen, Hanf und Mikroalgen liegen unterhalt der Anforderungen der WHO/FAQ/UNU. Dies bedeutet, dass die Versorgung ungenügend ausfallen würde, wenn man sich im Rahmen von 0,66g Protein pro Kilogramm Körpergewicht und Tag nur von diesen Lebensmitteln als Proteinquellen ernähren würde (siehe gestrichelte Linie). Für Sportler mit deren einerseits höherer Aufnahme pro Tag aber auch höherem Gesamtbedarf trifft dies zunächst keine verwertbare Aussage.
Auf Seiten tierischer Proteine**:
- Ei 32%
- Molkenprotein 43%
- Kalziumkaseinat 38%
- Milchprotein 39%
- Casein 34%
** hier liegen alle Werte über der WHO/FAQ/UNU-Vorgabe
Insgesamt finden sich in pflanzlichen Quellen mit durchschnittlich 26% des Gesamtproteingehalts weniger essentielle Aminosäuren als in tierischen Quellen mit durchschnittlich 37% und menschlichem Muskelgewebe mit 38% des Gesamtproteingehalts.
Hierzu interessant auch der Chart insgesamt enthaltener Aminosäuren (auch hier wieder ohne Tryptophan):
Fazit
Pflanzliche Proteinkonzentrate liefern insgesamt einen geringeren Anteil essentieller Aminosäuren als diese sich in tierischen Proteinkonzentraten finden. Angesichts der eingangs dargestellten Bedingungen für maximierte Muskelproteinsynthese stellt dies einen Nachteil für die Kategorie pflanzlicher Proteinquellen dar.
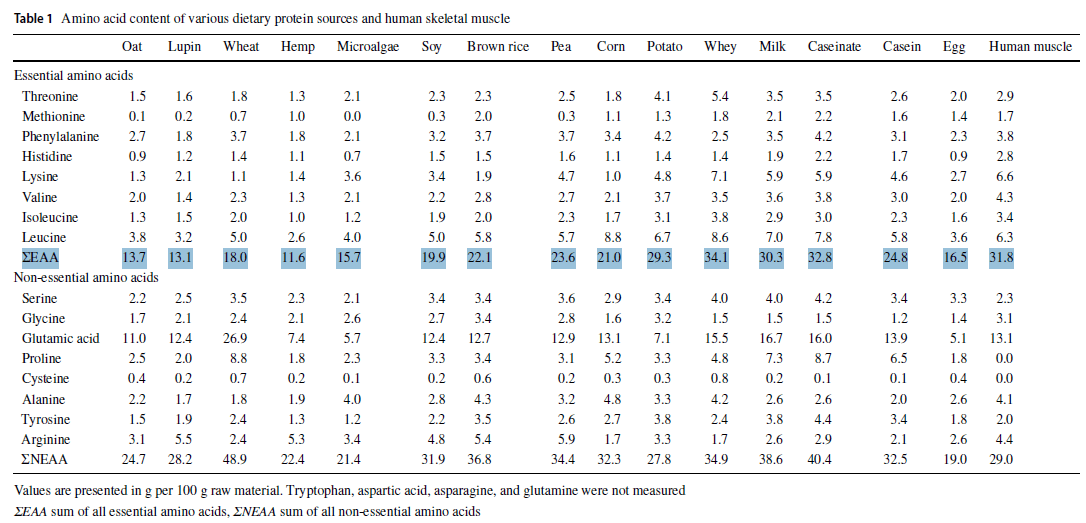
Aminosäurezusammensetzung im Vergleich
Die nächsten Darstellungen zeigen Unterschiede im Aufkommen essentieller Aminosäuren der verschiedenen Proteinkonzentrate. Die gestrichelte Linie markiert den nach WHO/FAQ/UNU notwendigen Referenzwert für die Anforderung an eine adäquate Aminosäureversorgung aus einem Lebensmittel.
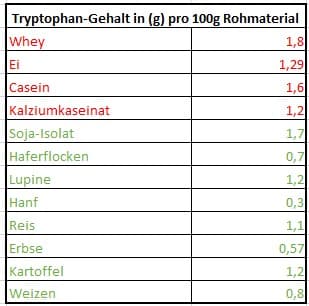
Da die Arbeit von Gorissen et al (1) Tryptophan ausspart, anbei Darstellungen die den Tryptophan-Gehalt pro 100 Proteinkonzentrat einzelner Quellen, sowie deinen Vergleich mit der menschlichen Aminosäure-Sequenz (2) aufzeigen.
Relativ eindeutig gehen größere Lücken in den Aminosäurebilanzen insbesondere bei pflanzlichen Proteinquellen hervor. Die EAA-Bilanzen tierischer Proteine scheinen dagegen relativ ausgeglichen und liegen (bis auf Phenylalanin bei Wheyprotein) allesamt über dem Referenzwert der WHO/FAQ/UNU-Vorgabe.
Fazit
Neben der insgesamt geringeren Menge essentieller Aminosäuren in Summe, zeigt sich bei pflanzlichen Proteinquellen häufiger auch eine unausgeglichene Aminosäurebilanz. Da die Gewichtung aller essentieller Aminosäuren zueinander als wichtiges Kriterium für maximierte Muskelproteinsynthese gilt, muss auch hier von Nachteilen pflanzlicher Proteinquellen ausgegangen werden.
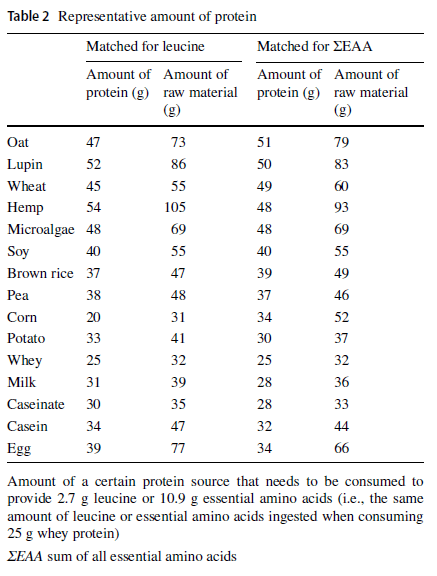
Wie viel Gramm Protein benötige ich?
An den bisherigen Charts erkennt man relativ klar die Lücken einiger pflanzlicher Proteinquellen in Hinblick auf die Gesamtmenge an essentiellen Aminosäuren aber auch auf die sog. limitierende Aminosäure als wichtigstes Kriterium für die Bildung von Protein im menschlichen Körper. Für maximierte Muskelproteinsynthese mit der Aufnahme von Nahrungsprotein pro Gabe, sind in der Praxis zwei Kennzahlen von besonderer Bedeutung:
- die sog. Leucinschwelle von ca. 3g
- die EAA-Menge einer Portion (Gabe) von 10 bis 12g
Beigefügte Darstellung zeigt, wie viel man von den einzelnen Proteinkonzentraten einnehmen müsste, um oben genannte Optimalwerte (hier 2,7g Leucin und 10,9g EAA) zuzuführen.
Fazit
Um optimale Voraussetzungen im Sinne des Gehalts an Leucin sowie essentieller Aminosäuren im Summe pro Gabe zu erreichen, müssen von pflanzlichen Proteinquellen tendenziell höhere Mengen eingenommen werden als dies bei tierischen Proteinquellen notwendig ist.
Aminosäurekonstellation die entscheidende Größe
Neben dem Leucin-Gehalt und der Gesamtmenge an essentiellen Aminosäuren pro Portion, entscheidet weiterführend auch die Konstellation der Aminosäuren zueinander wie effektiv Proteinaufbau wirklich stattfinden kann. Alles dreht sich hier um die sog. limitierende Aminosäure und damit das schwächste Glied zur Abbildung der benötigen Aminosäure-Matrix zur Bildung von körpereigenem Protein.
Der gesamte Zusammenhang lässt sich am Beispiel Maisprotein „Corn“ hervorragend erklären:
- Nur 31g Proteinkonzentrat wären nötig für 2,7g Leucin
- 52g Protein wären nötig für 10,9g EAA
- Lysin stellt die limitierende Aminosäure dar. Wird die fehlende Menge zur benötigten Matrix nicht ausgeglichen, kann trotz ausreichend Leucin sowie gesamter EAA nur begrenzt körpereigenes Protein gebildet werden.
Fazit
Proteinquellen vollständig auf deren Wertigkeit zu beurteilen bedeutet sowohl den Leucin-Gehalt, also auch die Menge enthaltener essentieller Aminosäuren sowie die Aminosäurekonstellation zu überprüfen. Letztlich legt die limitierende Aminosäure die Grenze für die Bildung körpereigenen Proteins fest.

Was kann daraus schlussfolgern
Essentielle Aminosäuren sind es, die man für die postprandiale Stimulation der Muskelproteinsynthese verantwortlich macht. Bis zu einer bestimmten Schwellenmenge besteht eine dosisabhängige Beziehung zwischen eingenommener EAA-Menge und Muskelproteinsynthesereaktion. Während insgesamt tierische Proteinquellen einen durchschnittlich höheren Gehalt an essentiellen Aminosäuren aufweisen, gibt es auch unter den pflanzlichen Proteinquellen einige Vertreter mit Mengen, die zumindest der WHO-Empfehlung für eine ausreichende Versorgung entsprechen. Kartoffelprotein (37%) liefert beispielsweise eine relativ ausgewogene EAA-Bilanz bei Mengen die denen von Casein (34%) oder Eiprotein (32%) überlegen sind.
Der Gehalt an Leucin fällt bei pflanzlichen Proteinträgern tendenziell geringer aus, als man ihn bei tierischem Protein oder aber in menschlichem Skelettmuskelprotein wiederfindet. Leucin übernimmt eine Schlüsselrolle für die Initiierung der Proteinsynthese. Über Signalwege wie mTORC1 stimuliert sie die Proteinsynthese. Der Leucin-Gehalt in Hanf (5,1%) und Lupinen (5,2%) gilt nach WHO als minderwertig. Ein Anteil von 5,9% wird für die Beeinflussung des Proteinstoffwechsels als notwendig erachtet. Während sowohl tierische, als auch alle anderen vorgestellten pflanzlichen Proteinquellen einen Anteil von mindestens 5,9% Leucin aufweisen, stechen Kartoffelprotein und Maisprotein mit Leucin-Mengen heraus, die denen einiger tierischer Proteinquellen überlegen sind.
Innerhalb der EAA-Matrix finden sich nicht immer, aber in einigen Fällen niedrigere Mengen einzelner essentieller Aminosäuren in pflanzlichen Proteinquellen. Als limitierende Aminosäuren begrenzen sie Proteinaufbau. Mit geschickten Kombinationen lässt sich die Aminosäurekonstellation und damit die Proteinwertigkeit verbessern, hierzu bedarf es jedoch eines gewissen Know-Hows sowie der Bereitschaft spezifische Kombinationen pflanzlicher Proteinquellen zuzubereiten und zu verzehren.
Bis zum heutigen Tage geht man davon aus, dass pflanzliche Protein nicht in der Lage sind die Muskelproteinsynthese in gleicher Weise anzuheben wie dies mit tierischem Protein möglich ist. Hierfür macht man einerseits die beschriebenen Umstände, aber auch weitere Gründe wie Unterschiede in der Absorption sowie die Verabreichung mit sogenannten Antinährstoffen verantwortlich. “Einfach mehr Protein verwenden“ im Sinne einer Erhöhung der Proteinmenge für eine Erhöhung der Menge an Leucin sowie enthaltener essentieller Aminosäuren stellt bei pflanzlichen Proteinen nicht immer eine Lösung dar. Zwar sorgte bei Lynch et al (3) die Verabreichung von 26g Sojaprotein-Isolat über 12 Wochen an untrainierten Probanden in Verbindung mit Krafttraining für vergleichbare Effekte bei Hypertrophie und Kraftaufbau wie diese mit 19g Wheyproten-Isolat auftraten. Sojaprotein stellt aus Sicht verschiedener Proteinbewertungen wie PDCAAS oder DIAAS jedoch ein hochwertiges Protein dar. Dies kann man nicht von allen anderen pflanzlichen Proteinvarianten behaupten. Insgesamt löst „einfach mehr Protein“ nicht immer das Problem der limitierenden Aminosäure, weshalb bestimmte pflanzliche Proteinvarianten entweder kombiniert oder durch isolierte EAA-Präparate mit ausgeglichener EAA-Matrix ergänzt werden sollten.
Die heute vorgestellte Untersuchung zeigt sehr schön auf, welche Komponenten für eine wirklich optimierte Muskelproteinsynthese entscheidend sind:
- EAA-Gehalt pro Portion
- Leucin-Gehalt pro Portion
- EAA-Konstellation
Sachlich und nüchtern betrachtet sind pflanzliche Proteinquellen als Kategorie hierzu insgesamt tierischen Proteinquellen unterlegen. Eine Feststellung die sich nach Sichtung aller Fakten nicht wegleugnen lässt, wenngleich es natürlich Mittel und Wege gibt, pflanzliche Proteine auf dem Niveau tierischer Proteine anzuwenden.
——————-
Nachtrag zur Verdaulichkeit
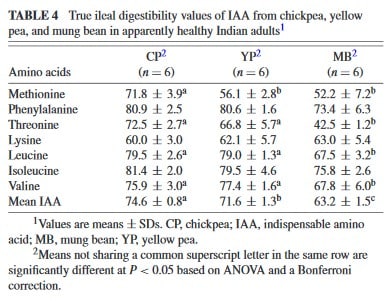
Eine interessante Studie von Kashyap et al (4) untersuchte jüngst die Verdaulichkeit dreier gängiger pflanzlicher Proteinquellen (Mungbohne (MB), gelbe Erbse (YP) und Kichererbse (CP)). Warum ist auch das wichtig? Erst die Verdaulichkeit eines Proteins, bzw. seiner enthaltener Aminosäuren gibt an, wie viel der oben dargelegten enthaltenen Aminosäuren überhaupt verwertbar nach der Verdauung im Körper ankommen.
Wie beigefügte Darstellung zeigt, bewegt sich die mittlere Verdaulichkeit im Bereich von 63 – 75% was an sich bereits ein Wert ist den man als „unterlegen“ verglichen mit tierischen Proteinträgern ansehen würde. Noch etwas schwieriger gestaltet sich die Tatsache, dass gerade bei den limitierenden Aminosäuren wie Methionin, Threonin oder Lysin erheblichere Einschränkungen der Verdaulichkeit bestehen. Ergo: „Das was eh bereits von Grund auf häufig fehlt wird auch noch schlechter aufgenommen“.
Die reduzierte Verdaulichkeit ergibt sich über enthaltene Phytosäuren, Polyphenole, Tannine, Hämagglutinine, Anthocyanidine, Trypsin sowie Protease-Inhibitoren aber auch im Falle intakter Zellwände (9).
Gegebenheiten dies noch komplizierter machen
1.
Die Studie stellt relevante Unterschiede in der Verdaulichkeit unterschiedlicher Sorten genannter Lebensmittel fest (bis 19%)
2.
Studienergebnisse die man gerne aus Tierstudien zur Verdaulichkeit zitiert sind auf den Menschen nicht vollends übertragbar. Es konnte gezeigt werden, dass die Verdaulichkeit bei beispielsweise Ratten höher ausfällt als beim Schwein oder beim Mensch (7).
3.
Die Verdaulichkeit der limitierenden Aminosäure Lysin lässt sich durch die Verarbeitung oder Zubereitung wenn überhaupt nur sehr gering verbessern. Studien berichten von Kochverlusten oder aber der Bildung Mayllard-ähnlicher Produkte die eine metabolische Verwertbarkeit mindern (5,8).
4.
Das oft gehörte und gelesene Argument „schälen, kochen, dämpfen, einweichen und Co verbessere die Verdaulichkeit“ gilt keinesfalls durchgehend. Am Beispiel der Mungbohne ließ sich in Tierstudien die Verdaulichkeit durch kochen um 20% anheben. Es bestehen allerdings Unterschiede in der Art des Kochens die bereits im Bereich von 16% angegeben wurden (6). Schälen sorgte getestet am Menschen um eine 8%-ige Verbesserung der Verdaulichkeit der Mungbohne, wobei hier hierzu auch Ergebnisse aus Tierstudien bestehen die von einer Verdaulichkeitsminderung im Bereich von 20% berichten (5,6). Selbst die Art des Schälens stellt eine Variable dar (6).
Fazit
JA man sollte über Methoden wie Einweichen, Schälen, Keimen, Fermentieren, Mahlen oder Druckkochen versuchen die Verdaulichkeit von pflanzlichem Protein bzw. den enthaltenen Aminosäuren zu verbessern. Eine allgemeingültige Garantie das dies auch funktioniert gibt es allerdings nicht (10).
Sportlicher Gruß

—————-
Quellen
(1)
https://pubmed.ncbi.nlm.nih.gov/30167963/
(2)
https://www.who.int/nutrition/publications/nutrientrequirements/WHO_TRS_935/en/
(3)
https://pubmed.ncbi.nlm.nih.gov/32486007/
(4)
https://academic.oup.com/ajcn/article/110/4/873/5543217
(5)
https://pubmed.ncbi.nlm.nih.gov/23107549/
(6)
https://link.springer.com/article/10.1007/BF01126555
(7)
https://pubmed.ncbi.nlm.nih.gov/23107538/
(8)
https://onlinelibrary.wiley.com/doi/abs/10.1002/jsfa.2740310505
(9)
https://www.sciencedirect.com/science/article/abs/pii/S0308814604000330
(10)
https://onlinelibrary.wiley.com/doi/book/10.1002/9781118846315