Wenn es um das Thema EAA (essentielle Aminosäuren) geht, findet man bei Body-Coaches nicht nur die aktuellsten, sondern auch ungeschönte und neutral gehaltene Informationen.
Eine Frage die in der Praxis von hoher Relevanz ist, befasst sich mit der nötigen EAA-Menge pro Portion um damit die Muskelproteinsynthese maximal zu stimulieren und weiterführend dank der richtigen Aminosäure Matrix auch Proteinaufbau maximal zu fördern. In vergangenen Beiträgen konnte dank bis dato verfügbarer Literatur eine Menge von 10g (oder 0,1 bis 0,14g/kg/kg) pro Portion (1,2,6-8) angegeben werden. Diese Zahl wollen wir heute ebenso einmal in Frage wie stellen, wie die grundlegende Überlegung, die Muskelproteinsynthese als Gradmesser für die Bestimmung der Aufnahme von Aminosäuren pro Gabe heran zu ziehen.
Viel Spaß

Best-Ager benötigen mehr …… vielleicht…. wahrscheinlich
Schon damals hatten wir die Vermutung in den Raum geworfen, dass es explizit für Best-Ager etwas mehr als besagte 10g EAA und insbesondere das darin enthaltene Leucin bedarf, um einer mit dem Alter fortschreitenden anabolen Resistenz entgegenzuwirken. Diese ist verantwortlich für eine Effizienzminderung der Muskelproteinsynthese mit fortscheitendem Alter (3,4). Neue Studien sprechen von 2,5g Leucin oder mehr pro Gabe als förderlich für optimierte Proteinsynthese explizit bei Best-Agern aus. Neben dieser Angabe zu Leucin wird zudem das „balaced eaa profile“, also eine ausgeglichene Aminosäurebilanz im Sinne der menschlichen Matrix als notwendiges Qualitätskriterium für Proteinträger benannt (11).
Wenngleich es Daten hierzu bisher noch nicht für Best-Ager im Bereich von 40 bis 65 Jahren gibt (4), haben wir bei der Konzeption des HBN Postworkout Complex best ager dennoch bereits reagiert und den Anteil an Gesamt-Leucin im Rahmen einer schlüssigen Gesamt-EAA-Matrix aus sowohl hochwertigen Proteinquellen, als auch aus isolierten essentiellen Aminosäuren erhöht.

Mehr EAA pro Portion im Kaloriendefizit
Etwas das bei der verallgemeinernden Aussage der 10g EAA pro Portion neben dem Alter ebenfalls nicht berücksichtigt wird, ist die kalorische Versorgung einer Person. Im Rahmen katabolischer Belastung stellt Muskulatur nicht das vorrangige Gewebe dar. Dies hat zur Folge, dass insbesondere im Energiedefizit gerne auf den gespeicherten Vorrat an Aminosäuren zurückgegriffen wird:
- um den erhöhten Aminosäurebedarf für lebenserhaltende Zwecke zu bedienen oder
- um Brennstoff zur Deckung des erhöhten Energiebedarfs zur Verfügung zu stellen. Dies bedeutet, dass Aminosäuren oxidiert werden.
Wird insgesamt nicht ausreichend Protein (EAA) über die Nahrung aufgenommen, kann dies den Abbau von Muskelprotein nochmals fördern.
Es erscheint aus diesem Grund wichtig sich mit der spezifischen Frage des EAA-Bedarfs unter hypokalorischen Bedingungen in Verbindung mit sportlicher Belastung auseinanderzusetzen. Hierzu stellen wir nun zwei Studien vor, die sich mit diesem Thema auseinandergesetzt haben.
Effects of high versus standard essential amino acid intakes on wholebody protein turnover and mixed muscle protein synthesis during energy deficit: A randomized, crossover study (5)
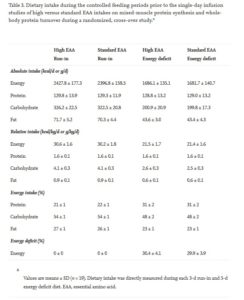
Gwin et al untersuchten unlängst, wie sich die Einnahme von EAA in einer Standartmenge oder aber in erhöhter Menge auf die Muskelproteinsynthese sowie den Gesamtkörperproteinumsatz im Kaloriendefizit auswirkt. 19 Probanden im mittleren Alter wurden hierzu jeweils über 5 Tage auf ein 30%-iges Kaloriendefizit gesetzt. Einmal erhielten sie nach Krafttraining verabreicht 0,1g EAA pro kg/kg und einmal 0,3g EAA pro kg/kg. Wichtig ist an dieser Stelle zu erwähnen, dass der Gesamtproteingehalt (1,6g/kg/kg) der verabreichten Nahrung in beiden Versuchen gleich gehalten wurde. Ebenso nahmen die Gruppen dieselbe Menge Gesamtkalorien zu sich. Im Versuch wurden so durchschnittlich 7,87g EAA oder 23,5g EAA pro Gabe verabreicht.
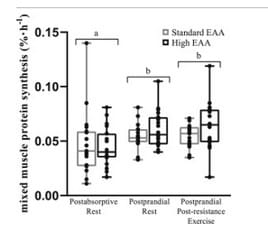
Es zeigte sich, dass die Ganzkörperproteinbilanz mit höherer EAA Verabreichung größer ausfiel. Schuld daran hatten sowohl ein stärkerer Anstieg der Ganzkörperproteinsynthese als auch eine Verringerung des Ganzkörperproteinabbaus verglichen mit den Werten der Standartmenge. Interessanterweise kam es zum verringerten Proteinabbau unabhängig von einer Erhöhung des Insulinaufkommens dank insulinogener Aminosäuren denn diese viel in etwa gleich aus.
Muskelspezifisch kam es binnen 3 Stunden nach der Verabreichung zu vergleichbaren Effekten auf die Proteinsynthese. Diese Beobachtung legt nahe, dass wahrscheinlich kein muskelspezifischer Vorteil einer Erhöhung der EAA-Aufnahme in freier Form über die aktuellen Empfehlungen von 0,10-0,14 g EAA/kg pro Dosis hinaus besteht, auch nicht unter hypokalorischen Bedingungen. Die Beobachtung lässt weiter vermuten, dass höhere EAA-Gaben eher Proteinverluste des gesamten Körpers ausgleichen die durch katabolen Stress der Unterernährung verursacht werden (35,36).
Fazit
Eine Erhöhung der EAA-Menge von 0,1kg/kg auf 0,3g/kg/kg birgt in Hinblick auf die Muskelproteinsynthese keinen Vorteil. Da sich eine signifikante Erhöhung des Gesamtproteinturnovers zeigte, sehen die Forscher höhere EAA-Dosen als notwendig an um sowohl den Muskel- als auch den Ganzkörperproteinstatus während kataboler Stressphasen ausgelöst durch eine Unterernährung zu optimieren.

Muscle Protein Synthesis and Whole-Body Protein Turnover Responses to Ingesting Essential Amino Acids, Intact Protein, and Protein-Containing Mixed Meals with Considerations for Energy Deficit (37)
Ebenfalls von Gwin et al stammt eine zweite Arbeit die sich ebenfalls mit der Frage beschäftigt, inwieweit bisweilen gängige Empfehlungen für die Aufnahme von Protein oder EAA pro Mahlzeit auch dann Gültigkeit haben, wenn ein Energiedefizit besteht.
Aus verfügbarer Literatur geht hervor, dass sich mit der Aufnahme von 0,25 bis 0,4g/kg/kg (junge Trainierende) und 0,4 bis 0,6g/kg/kg (ältere Trainierende) bzw. 10g oder 0,1g bis 0,14g/kg/kg EAA sowohl in Ruhe als auch unter Belastungsbedingungen die Muskelproteinsynthese maximal stimulieren lässt, sofern sich die Gesamtproteinaufnahme im Bereich von 1,6g/kg/kg bewegt (34). Weiter geht von 10 g EAA pro Gabe mit einem Leucin-Gehalt von 1,8 g eine maximale Muskelproteinsynthese-Reaktion bei jungen gesunden Erwachsenen in Ruhe aus.
Unter defizitären Bedingungen tragen mehrere Faktoren zu einem Verlust an Magermasse bei (12-18):
- herabregulierte Muskelproteinsynthese
- abgestumpfte (durch die Muskelproteinsynthese assoziierte) anabole Signalantworten als Reaktion auf Nährstoffzufuhr
- erhöhte Ganzkörper-Proteinoxidation
- Verwendung von Nahrungsprotein als leicht verfügbare oxidierbare Energiequelle zur Deckung des bestehenden Bedarfs
EAA-Anstieg und Muskelproteinsynthese
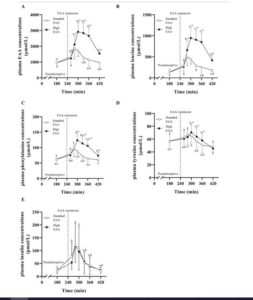
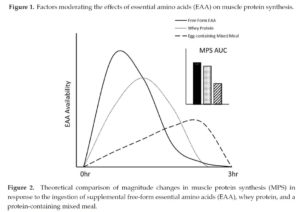
Die akute Reaktion der Muskelproteinsynthese steht im Einklang mit dem Anstieg des Blut-EAA-Spiegels. Da frei verfügbare isolierte essentielle Aminosäuren nicht verdaut werden müssen, geht von ihnen hier verglichen mit Wheyprotein oder einer vollwertigen Mahlzeit der höchste Proteinsyntheseanstieg aus. Neben der Darreichungsform beeinflussen auch die absolut verabreichte Menge an EAA sowie die Zusammensetzung den Zirkulationsverlauf.
Man geht davon aus, dass 8-10 g EAA [25,72] die Muskelproteinsynthese unabhängig von der Energiebilanz und moderaten Energiedefizitbedingungen optimal stimulieren.
Muskelproteinsynthese trifft nur eine halbe Aussage
Problematisch gestaltet sich wie so oft beim Thema Aminosäuren (wir kennen es von BCAA) die Beleuchtung lediglich einer Komponente des Protein-Turnovers, nämlich der Muskelproteinsynthese. Vollständig wird eine Überlegung erst, wenn man sowohl Muskelproteinsynthese als auch Muskelproteinabbau darin berücksichtigt. Tatsächlich weiß man um Situationen bei denen die Muskelproteinsynthese aufgrund Aminosäureverfügbarkeit hoch gemessen werden kann, der Proteinabbau aber derart hoch ausfällt, dass insgesamt eine protein-katabole Situation herrscht (19,20).
Ganzkörper-Proteinbalance übergeordnete Maßeinheit
Noch einen Schritt weiter gehen Überlegungen die (wie bereits in Studie 1 erwähnt) den gesamten Proteinturnover des Körpers berücksichtigen. In bestimmten Situationen können EAA nach gesättigter Muskelproteinsynthese noch immer dazu verwendet werden, die Proteinsynthese an anderen Stellen des Körpers zu unterstützen. Dies wiederum verringert die Rate abgebauten Proteins als zweite wichtige Größe des Proteinturnovers.
Besonders im einem Zustand von katabolischem Stress kann und werden Aminosäuren neben der Proteinsynthese auch für Notwendigkeiten wie die Immunfunktion, die Wundheilung oder aber die Energieproduktion verwendet. Da die Skeletmuskulatur als labile Energiequelle fungiert, kann es so schnell zu vermehrtem Proteinabbau kommen, den es einzudämmen gilt (22,23).
Interessant
Skelettmuskulatur speichert etwa 40% zum Ganzkörperproteins und ist in ~33-50% des Ganzkörperproteinumsatzes involviert (24).
So gibt es ganz konkret Studien die mit Verabreichung einer Mahlzeit mit 70g Protein (32g EAA) verglichen mit einer Mahlzeit mit 40g Protein (18g EAA) zwar vergleichbare Effekte auf die Muskelproteinsynthese, jedoch deutlich größere Effekte auf die Ganzkörper-Proteinbalance aufzeigen (25).
Nochmals relevanter erscheint dieser Gesichtspunkt unter defizitären Bedingungen, wenn (wie oben genannt) Nahrungsprotein für eine Reihe anderer Funktionen eingesetzt werden kann die eine höhere Priorität genießen als den muskulären Proteinstoffwechsel zu bedienen. Nicht umsonst ist in Abhängigkeit von Dauer und Ausprägung ein Energiedefizit mit einem Verlust an Muskelmasse verbunden (27,28).
Basierend auf dieser Überlegung erscheint es nicht weiter verwunderlich, dass Nahrungsprotein im Bereich von 1,4g bis 2,4g/kg/kg und Tag in einem moderaten Defizit von 40% in der Lage ist, einen Verlust an fettfreier Masse einzudämmen. Auf der anderen Seite reichen sonst übliche 20 bis 25g Molkenprotein pro Gabe hier nicht aus, um Muskelmasse im erheblichen Defizit zu erhalten (29,30).
Interessant
Die Größe des Energiedefizits fungiert als wichtiger Moderator dafür, ob Nahrungsprotein zur Unterstützung der Proteinsynthese und zur Schonung der fettfreien Masse verwendet, oder in den oxidativen Energiestoffwechsel umgeleitet wird.
Obwohl es keinen Unterschied in der Muskelproteinsynthese-Reaktion gibt, wirken sich 24g EAA anstelle von 8g EAA positiv sowohl auf die Ganzkörper-Proteinsynthese als auch auf den Ganzkörper-Proteinabbau aus. Die höhere Menge verbessert so die Ganzkörper-Proteinbilanz (31-33). Eine positive Ganzkörper-Proteinsynthese wirkt sich umgekehrt auch immer positiv auf Muskelmasse aus. Sie wird bei defizitärere Versorgung gerne entweder als Energielieferant verwendet oder versorgt andere Gewebe die relevanter für das Überleben des gesamten Organismus erscheinen.
Wichtig für die Ganzkörper-Proteinbalance erscheint neben der Menge an EAA auch die Zusammensetzung Im Vergleich mehrerer isostickstoffhaltiger und isokalorischer Mahlzeiten sind proteinhaltige Mischmahlzeiten mit unterschiedlichen EAA-Zusammensetzungen in der Lage die Ganzkörper-Proteinbalance unterschiedlich zu beeinflussen obwohl sowohl eine ähnliche Proteinmenge, als auch vergleichbare Muskelproteinsynthese-Reaktionen gegeben ist (26).
Resümee
Betrachtet man die reine Muskelproteinsynthese würden 10g EAA oder 0,1g bis 0,14g EAA pro kg/kg und Gabe weiterhin als gültige Maßeinheit gelten. Der Ansatz den Gwin und Kollegen erscheint jedoch sowohl äußerst fortschrittlich, also auch absolut logisch.
- Warum stütz sich die Bewertung von Proteingaben lediglich auf eine Komponente des Gesamt-Proteinturnovers, nämlich die Muskelproteinsynthese?
- Warum dachte man bisher, dass eine Stimulierung der Muskelproteinsynthese alleine darüber bestimmt, wie viel essentielle Aminosäure pro Gabe sinnvoll erscheinen?
Insgesamt lassen die zitierten Arbeiten den Schluss zu, dass wir es im energetischen Defizit mit einer höheren Bedarfssituation an essentiellen Aminosäuren zu tun haben um die gesamte Proteinbalance aufrecht zu halten. Dies wiederum bedeutet indirekten Schutz von Muskelmasse, fernab einer ausbleibenden zusätzlichen Stimulierung der Muskelproteinsynthese.
Bis dato gibt es noch keine genaue Angabe wie viel „mehr“ von Nöten ist. Sicher handelt es sich je nach Höhe und Dauer des Defizits sowie in Abhängigkeit der vorhandenen Muskelmasse auch um eine variierende Zahl.
Eine Erhöhung der EAA-Menge pro Gabe auf 0,3g/kg/kg scheint angesichts des Versuchs von Gwin und Kollegen derzeit die beste Empfehlung für hypokalorische Phasen zu sein, so lange bis differenziertere Ergebnisse vorliegen.
Sportlicher Gruß
www.Body-Coaches.de

Quellen
(1)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3284412/pdf/1743-7075-9-5.pdf
(2)
https://nutritionandmetabolism.biomedcentral.com/articles/10.1186/1743-7075-7-51
(3)
https://pubmed.ncbi.nlm.nih.gov/15596483/
(4)
https://www.body-coaches.de/10g-eaa-aus-hbn-eaa-code-pro-portion-die-richtige-empfehlung
(5)
https://www.clinicalnutritionjournal.com/article/S0261-5614(20)30384-8/abstract
(6)
https://academic.oup.com/jn/article/143/11/1811S/4637685
(7)
https://jissn.biomedcentral.com/articles/10.1186/s12970-017-0177-8
(8)
https://europepmc.org/article/med/26891166
(9)
https://europepmc.org/article/med/25386980
(10)
https://pubmed.ncbi.nlm.nih.gov/28385919/
(11)
https://doi.org/10.1093/advances/nmaa047
(12)
https://pubmed.ncbi.nlm.nih.gov/29878853/
(13)
https://faseb.onlinelibrary.wiley.com/doi/full/10.1096/fj.13-230227
(14)
https://academic.oup.com/jn/article/145/2/246/4585697
(15)
https://journals.physiology.org/doi/full/10.1152/ajpendo.00590.2013
(16)
https://journals.physiology.org/doi/abs/10.1152/jappl.1991.70.1.43
(17)
https://academic.oup.com/ajcn/article-abstract/46/4/557/4694572?redirectedFrom=fulltext
(18)
https://pubmed.ncbi.nlm.nih.gov/6476111/
(19)
https://pubmed.ncbi.nlm.nih.gov/12107253/
(20)
https://pubmed.ncbi.nlm.nih.gov/29368185/
(21)
https://journals.physiology.org/doi/full/10.1152/japplphysiol.00076.2009
(22)
https://pubmed.ncbi.nlm.nih.gov/12107253/
(23)
https://academic.oup.com/ajcn/article/68/1/12/4666020
(24)
https://www.annualreviews.org/doi/10.1146/annurev.nutr.20.1.457
(25)
https://journals.physiology.org/doi/full/10.1152/ajpendo.00365.2015
(26)
https://linkinghub.elsevier.com/retrieve/pii/S0261561417313572
(27)
https://link.springer.com/article/10.1007%2Fs40279-018-0945-x
(28)
https://journals.physiology.org/doi/abs/10.1152/jappl.1994.77.2.933
(29)
https://faseb.onlinelibrary.wiley.com/doi/abs/10.1096/fasebj.2018.32.1_supplement.909.6
(30)
https://pubmed.ncbi.nlm.nih.gov/27054679/
(31)
https://www.clinicalnutritionjournal.com/article/S0261-5614(20)30384-8/fulltext
(32)
https://www.clinicalnutritionjournal.com/article/S0261-5614(17)31430-9/fulltext
(33)
https://pubmed.ncbi.nlm.nih.gov/16848698/
(34)
https://pubmed.ncbi.nlm.nih.gov/25056502/
(35)
https://journals.physiology.org/doi/full/10.1152/japplphysiol.01039.2016
(36)
http://refhub.elsevier.com/S0261-5614(20)30384-8/sref39
(37)