Milch zählt zu den am stärksten kritisierten Lebensmitteln. Kein Wunder, denn auch die Wissenschaft präsentiert sich alles andere als einig über deren gesundheitliche Bedeutung:
- Eine Vielzahl an Studien spricht sich für eine verbesserte Diät-Qualität, gesundheitliche Vorteile sowie eine positive Beeinflussung der Körperzusammensetzung, der Knochengesundheit oder der Darmflora bei Erwachsenen und bei Kindern, sowie gegen Sarkopenie bei älteren Menschen aus (1-9,49,150)
- Eine größere Zahl an Studien spricht oben genannte Vorteile zumindest bestimmten (meist fermentierten) Milchprodukten oder bestimmten Zufuhrmengen zu (10-17)
- Eine gewisse Zahl an Studien sieht den Effekt von Milchprodukten auf die Gesundheit sowie beispielsweise auf das Frakturrisiko oder die Darmflora als noch nicht ausreichend erforscht für eine klare Aussage an (18-21)
- Einige Studien stellen fest, dass Milchprodukte das Risiko auf bestimmte Krankheiten nicht fördern (z.B. Darmkrebs, Diabetes, Übergewicht, kardiometabolisches Risiko, Bluthochdruck) (22-27)
- Einige Studien sprechen Milchprodukten deren Effekte auf die Gesundheit ab, grenzen sie ein (28), oder berichten von nachteiligen Effekten wie jüngst auf die Insulinsensitivität bei Personen mit metabolischem Syndrom (117)
Nebst aller Untersuchungen, wird gerade bei Milchprodukten zudem ein starker Lobbyismus unterstellt, ergo positive Ergebnisse seien von Geldgebern der Milchindustrie finanziert. Als tierisches Lebensmittel muss sich Milch darüber hinaus auch die Kritik der veganen Bewegung gefallen lassen. Hier geht es nochmals um gänzlich andere Themen wie die Haltung von Nutztieren oder andere ethische Gesichtspunkte.
Eine interessante Betrachtungsweise der gesamten Thematik rundum Milchprodukte möchte ich heute mit euch teilen. Ein wertvolles Lebensmittel definiert sich in meinen Augen über seinen Anteil an wertvollen Nährstoffen zur Abdeckung des täglichen Bedarfs. Hierbei geht es zum einen um den Gehalt an sich, aber auch um die Bioverfügbarkeit. Genau eine solche Betrachtungsweise einmal für Milchprodukte sowie das pflanzliche Pendant Obst und Gemüse möchte ich heute mit dir teilen um Licht ins Dunkel zu bringen.
Viel Spaß!

Bioverfügbarkeit – Definition und Bestimmung
Wenngleich es sich als hilfreich erweisen hat, einzelne Nährstoffe oder Lebensmittelkomponenten in Bezug auf gesundheitliche Ergebnisse zu untersuchen, geht man heute davon weg und befasst sich mit komplexeren Effekten mehrerer Substanzen im Verbund, beginnend beim Lebensmittel, bis hin zum gesamten Ernährungsmuster.
Obwohl die Bioverfügbarkeit einiger Nährstoffe als recht gut verstanden gilt, sieht sich die Wissenschaft bei anderen Nährstoffen noch im Anfangsstadium. Bis zum heutigen Tage stehen nur begrenzte Ergebnisse aus Humanstudien zur Bioverfügbarkeit zur Verfügung.
Per Definition handelt es sich bei Bioverfügbarkeit um den Anteil eines aufgenommenen Nährstoffes der für die Verwendung und Speicherung im Körper verfügbar wird (29). Es geht also neben der bloßen Aufnahme aus dem Darm auch um die Verwendung und Speicherung (Retention) im Körpergewebe. Zu unterscheiden gilt es bei der Bestimmung in-vitro-Methoden (Reagenzglas) von in-vivo-Methoden (am lebenden Objekt). Letztgenannte lassen eine genauere Übertragung der Ergebnisse auf Ganzkörperbedingungen am Menschen zu (30-32).
Fazit
Nicht alleine die netto aufgenommene Menge, sondern auch die tatsächlich für verwertbare Menge für den Körper ist in Hinblick auf die Nährstoffversorgung von Bedeutung.

Milch und Milchprodukte
Wenn von Milch die Rede ist, meint man damit in den meisten Fällen Kuhmilch. Zu unterscheiden gilt es davon die Kategorie der Milchprodukte mit Vertretern wie z.B. Buttermilch, Quark, Joghurt, Käse sowie andere eng verwandte Produkte. Milch als Vollmilch leistet besonders dank seines Gehalts an Protein und Fett einen relevanten Beitrag zur Kalorienaufnahme. Weltweit fällt die Aufnahme von Milch (ohne Milchprodukte) unterschiedlich stark aus (29):
- ~200-240 g pro Tag in Westeuropa und Nordamerika
- ~130-300 g pro Tag in Lateinamerika
- ~100-200 g pro Tag in Afrika
- 20-150 g in Asien
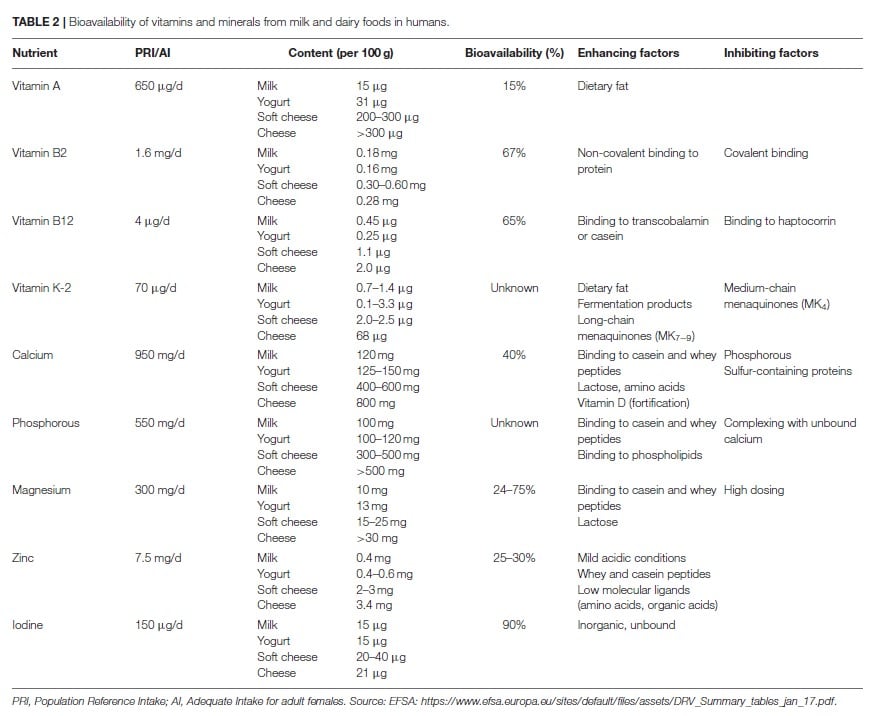
In den Industrieländern gilt Milch als wichtige Kalziumquelle, trägt aber auch zu 20 bis 40% zur Aufnahme der Vitamine A, B2, B12 und K sowie von Phosphor, Magnesium, Zink und Jod bei (33-44).
Sehen wir uns nun einmal die Bestandteile im Einzelnen an.
Milch als Kalziumquelle
Auch wenn es nicht durchgängig so dargestellt wird, handelt es sich bei Milch um die wichtigste Kalziumquelle in der menschlichen Ernährung. Der Kalziumgehalt in Kuhmilch wird mit durchschnittlich 120 mg pro 100 ml angegeben. In Europa und Nordamerika stammen etwa 75% des ernährungsbedingten Kalziums aus Milch und Milchprodukten, weitere 15% aus Gemüse und Obst, 5% aus Mineralwasser und der Rest aus anderen Lebensmitteln (45,46).
Etwa 40% des Kalziums aus Milchquellen werden unter normalen Umständen absorbiert. Die Absorption fällt bei Kindern insgesamt höher aus als bei älteren Menschen (47, 48).
Etwa 99% der Kalziumvorräte des Körpers finden sich in den Knochen. Die Effizienz der Kalziumeinlagerung im Knochengewebe ist von mehreren physiologischen Faktoren abhängig (z.B. Wachstum, Schwangerschaft und Laktation) und wird zugleich von verschiedenen Hormonen reguliert:
- PTH
- Calcitonin
- Calcitriol
- Östrogene
Übermäßig absorbiertes Kalzium wird mit Urin, Kot oder Schweiß ausgeschieden. Erwachsene weisen nach dem Höchststand an Knochenmasse mit etwa 35 Lebensjahren danach im Allgemeinen eine negative Kalziumbilanz auf und verlieren so täglich etwa 10 mg Kalzium. Bei Frauen nach der Menopause kann der tägliche Verlust auf bis zu 40 mg pro Tag und mehr ansteigen (50).
Die Bioverfügbarkeit von Kalzium wird einerseits durch die Resorption im Dünndarm und andererseits durch die Einlagerung in das Knochengewebe bestimmt. Beide Prozesse können durch diätetische Faktoren beeinflusst werden.
Die Bioverfügbarkeit von Kalzium definiert sich als der Anteil an Kalzium aus der Nahrung, der vom Darm resorbiert und für die Knochenmineralisierung verwendet wird.
Die intestinale Resorption von Kalzium erfolgt meist durch passive Diffusion, während der aktive Transport bei geringer und mittlerer Kalziumaufnahme unter der Regulation von Vitamin D erfolgt (51). Es konnte gezeigt werden, dass die Anreicherung von Milch mit Vitamin D die Calciumresorption verbessert (52).
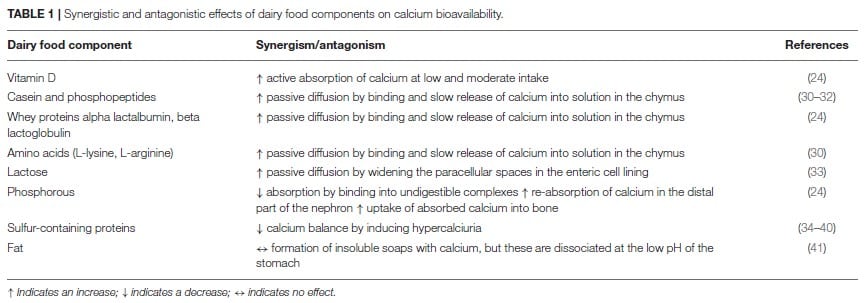
Eine Reihe spezifischer Bestandteile in Milch beeinflusst die Absorption von Kalzium:
Positiv
Phosphopeptide, die Molkenproteine Alpha-Lactalbumin sowie Beta-Lactalbumin, Lysin und Arginin sorgen dafür, dass an sie gebundenes Kalzium leicht freigesetzt und langsam in Lösung gebracht wird. Dies stellt eine wichtige Voraussetzung für passive Diffusion dar (51,53).
Auch Laktose verbessert die Kalziumabsorption in dem es die parazellulären Räume in der enterischen Zellauskleidung erweitert und dadurch passive Diffusion fördert (54,55). Dies scheint jedoch nur bei relativ hohem Aufkommen an Laktose weit über den typischerweise in Milch oder Milchprodukten enthaltenen Mengen aufzutreten (56,57,58). Ansonsten räumt man Laktose eine gewisse Bedeutung für die Kalziumaufnahme ein, wenn hoher Zufuhrmengen auf eine schlechte Löslichkeit treffen. Dies ist nicht selten bei Säuglingen oder älteren Menschen der Fall (59,60). Hier scheint Laktose die Kalziumabsorption im Zökum und Dickdarm zu fördern, indem sie das Wachstum von Bifidobakterien anregt und dadurch einen niedrigen pH-Wert im Darm aufrechterhält (61,62). Personen mit Laktose-Mangel weisen jedoch nicht zwangsläufig auch eine beeinträchtigte Kalziumabsorption auf (63).
Negativ
Eiweiß, insbesondere schwefelhaltiges Eiweiß, führt über eine erhöhte Kalziumausscheidung im Urin nachweislich zu einer negativen Kalziumbilanz (64). Arbeiten von Rizzoli et al (65) und Bonjour et al (66) kann man entnehmen, dass eine proteinreiche Ernährung, mit entweder tierischen oder pflanzlichen Quellen, eine erhöhte Kalziumausscheidung über den Urin zur Folge hat. Dies begründet sich jedoch in erster Linie über eine höhere Kalziumabsorption im Vorfeld aus dem Darm.
Milchfette können mit Kalzium unlösliche Seifen bilden. Bei niedrigem pH-Wert im Magen werden diese jedoch aufgelöst und wirken sich daher nicht negativ auf die Kalziumbioverfügbarkeit aus (67). Dieser Vorgang erklärt, warum Kalzium aus Käse trotz des hohen Gehalts an gesättigten langkettigen Fettsäuren als leicht absorbierbar gilt (68).
Phosphor bindet einerseits Kalzium und hemmt damit seine Absorption im Dünndarm. Dies fördert die Ausscheidung von Kalzium im Stuhl. Andererseits verbessert es die Resorption von Kalzium in den Nieren (Nephron) und erhöht die Aufnahme von absorbiertem Kalzium in die Knochen (66). Das empfohlene Verhältnis von Kalzium (mg) zu Phosphor (mg) in der Nahrung reicht von 1:1 bis 1,5:1, wobei Verhältnisse unter 0,5 mit einer Abnahme der Knochenmineraldichte verbunden sind (69). Zu viel Phosphor im Verhältnis zu Kalzium verringert zudem die Bildung von 1,25-Dihydroxyvitamin D3 und reduziert damit die intestinale Kalziumabsorption (70,71). In Kuhmilch kommen Kalzium und Phosphor in einem ausgewogenen Verhältnis von etwa 1,2:1 vor.
Die intestinale Resorption von Kalzium aus Milch und Milchprodukten fällt im Vergleich zu anderen Quellen wie Kalziumsalzen, Gemüse oder Mineralwasser sehr ähnlich aus. Recker & Heany (72) gehen dennoch bei Milchprodukten von einem insgesamt höheren Nettoeffekt auf die Kalziumretention aus. Zwischen den verschiedenen Milchprodukten (Milch, Sauermilch, Joghurt, Magermilch, Frischkäse, Hartkäse) besteht nur ein geringer Unterschied (64).
Diäten, die Milchprodukte einschließen, können als geeignete Option angesehen werden, um negative gesundheitliche Auswirkungen im Zusammenhang mit einer negativen Kalziumbilanz zu verhindern.
Milch als Vitamin A Quelle
Der Gehalt an Vitamin A in Milchprodukten liegt zwischen 15μg in 100 ml Milch und über 300 μg in 100 g Vollfettkäse. In Milchprodukten findet sich Vitamin A vorwiegend als Retinylpalmitat (73). Geringe Mengen liegen auch als ß-Carotin an.
Über die Bioverfügbarkeit von Vitamin A aus Milch und anderen Milchprodukten ist wenig bekannt. Eine Studie berichtet, dass etwa 15% des Vitamin A aus Milch absorbiert werden. Auch bei angereicherter Milch ergeben sich keine höheren Werte, ebenso wenig wie es einen Unterschied macht, ob Vollmilch oder Magermilch verabreicht werden (74).
Milch als Vitamin B2 Quelle
Mit 0,18 mg Riboflavin pro 100 ml Milch und 0,28 mg pro 100 g Käse fungieren Milchprodukte als wichtige Quelle für wasserlösliches Vitamin B2. Dainty et al (76) gehen von einer Bioverfügbarkeit bei Riboflavin aus Milchprodukten in Höhe von etwa 67% aus.
Milch als Vitamin B12 Quelle
Milch enthält etwa 0,40 bis 0,45 μg Vitamin B12 pro 100 ml. Käse kann bis zu 2 μg pro 100 g enthalten. Die wichtigsten Derivate von Vitamin B12 in Kuhmilch sind Hydroxycobalamin, Adenosylcobalamin und Methylcobalamin. Diese sind je nach Rasse des Nutztieres meist an die Proteine Haptocorrin, Transcobalamin und Casein gebunden (77, 78). Während es in vitro zu unterschiedlichen Ergebnissen hinsichtlich der Bioverfügbarkeit in Abhängigkeit des Bindungsproteins kam, zeigt eine Studie an gesunden Erwachsenen über 60 Jahre, dass etwa 65% des Vitamin B12 aus Milch absorbiert wurden (79). Die Absorption von Vitamin B12 aus tierischen Nahrungsmitteln insgesamt beträgt dem gegenüber 50% oder weniger. Bei synthetischen Nahrungsergänzungen geht man sogar von unter 5% aus (80). Contraire zu diesen Zahlen zeigt eine Studie von Naik et al (81) ähnliche Veränderungen des Vitamin B12 Status mit der Einnahme von Cyano-B12 aus einem Supplement oder endogenem Hydroxo-B12, verabreicht mit Wheyprotein.
Milch als Vitamin K2 Quelle
Da Menachinone hauptsächlich von Bakterien synthetisiert werden, eignen sich fermentierte Milchprodukte wie Joghurt und Käse besonders als gute Quellen. Milch enthält etwa 0,7 bis 1,4 μg Menachinone pro 100 ml. Vollfetter Hartkäse liefert bis zu 68 μg pro 100 g. Insbesondere die Einnahme von langkettigen Menachinonen (MKn) wurde mit einem verringerten Risiko für Herz-Kreislauf-Erkrankungen in Verbindung gebracht (82,83). Zu Phylloquinon (Vitamin K-1), welches aus pflanzlichen Nahrungsmitteln gewonnen wird, besteht ein solcher Zusammenhang nicht. Wie bereits erwähnt, finden sich die höchsten Mengen an Menachinon bei Milchprodukten in fermentiertem Käse und werden in positiver Beziehung zum Fettgehalt bewertet (84,85). Letzteres begründet sich darüber, dass Vitamin K ein fettlösliches Vitamin ist und als solches über den Lipidweg absorbiert wird. Die Bioverfügbarkeit von Menachinonen aus Milchprodukten wurde bisher nicht am Menschen untersucht. Ausnahme bildet eine einzige Studie die aufzeigt, dass MK7 in Joghurt im Vergleich zu MK7 aus Weichgelkapseln leicht höhere Plasmakonzentrationen herbeiführt (86). In Hinblick auf die Darreichungsform werden MK7-9 besser absorbiert als MK4. MK7-9 weisen zudem eine längere Halbwertszeit auf als Vitamin K-1 (87,88).

Milch als Zink Quelle
Mit einer Konzentration von 0,4 mg Zink pro 100 ml handelt es sich bei Milch um eine relevante Zinkquelle. Zink ist vorwiegend in Caseinmicellen enthalten, wird aber schon unter mäßig sauren Bedingungen leicht freigesetzt (91). Ungefähr 25 bis 30% des Zink aus Milch werden absorbiert (92,93). Eine Reihe von Substanzen wie Molke- und Kaseinpeptide, Chelatoren, Histidin, Methionin sowie organische Säuren (Zitronen-, Äpfel- und Milchsäure) sind in der Lage die Zinkabsorption zu fördern (94).
Milch als Phosphor Quelle
Mit einem Gehalt von etwa 100 mg Phosphor pro 100 ml Milch und über 500 mg pro 100 g Käse stellen Milchprodukte eine wichtige Phosphorquelle dar. Obwohl noch immer nur wenige Daten vorliegen, geht man davon aus, dass Phosphor aus tierischen Nahrungsmitteln besser bioverfügbarer ist als Phosphor aus pflanzlichen Nahrungsmitteln. Man schließt hierauf aus Bilanzstudien, die die Phosphoraufnahme aus Nahrungsquellen mit der Harnausscheidung abgleichen (89,90). Möglich wird der Vorteil über die Bindung von Phosphor an verdauliche Verbindungen in tierischen Lebensmitteln (z.B. Proteine oder Phospholipide). Die Kehrseite von Phosphor ist die Bildung unverdaulicher Komplexe im Verdauungstrakt (z.B. mit Kalzium). Die Bioverfügbarkeit von Phosphor kann weiter stark von der Wechselwirkung mit anderen Mahlzeitkomponenten abhängen (89). Bislang wurden keine Studien durchgeführt, welche die Bioverfügbarkeit von Phosphor aus Nahrungsquellen beim Menschen direkt bestimmen.
Milch als Magnesium Quelle
Milch enthält etwa 10 mg Magnesium pro 100 ml. Der Gehalt in anderen Milchprodukten wie z.B. Käse kann weitaus höher ausfallen. Die Absorption von Magnesium aus Milch fällt stark dosisabhängig aus. Es scheint einen sättigbaren Mechanismus zu geben. Höhere Mengen werden hauptsächlich per einfache Diffusion aufgenommen. Aus einer Portion Milch mit 46mg Magnesiumanteil wurden in der Studie von Ekmekcioglu etwa 75% absorbiert (95). Peptide aus Kasein oder Molke sind in der Lage die Absorption zu fördern. Auch von Laktose ist dies bekannt, allerdings nur aus dem Tiermodell (96,97) und bis dato nicht am Menschen (98).

Milch als Jod Quelle
Der Jodgehalt in Milch unterliegt erheblichen Schwankungen im Bereich von 3,3 bis 53,4 μg pro 100 ml. Abhängig gemacht wird dies (99,100):
- von der Haltungsform der Nutztiere
- von Jodaufnahme der Milchkühe
- von der Verwendung jodhaltiger Euterreiniger
- von der Jahreszeit
- von der Verarbeitung des Milchprodukts
Über 80% des Jods in liegt als anorganisches Jodid mit einer entsprechend hohen Bioverfügbarkeit von etwa 90% vor (101).
Fazit
Milch und Milchprodukte verstehen sich neben deren Rolle als exzellenter Lieferant von Protein höchster biologischer Wertigkeit zudem als relevante Lieferanten etlicher Nährstoffe des täglichen Bedarfs mit teilweise guter, bis sogar überlegener Bioverfügbarkeit. Thesen denen zur Folge Milch sogar ein Nährstoffräuber sei, erscheinen abwegig und entsprechen nicht der Wahrheit. Das oft genannte Argument des sauren Milieus dank Milch welches zur Auslösung von Kalzium aus den Knochen führt ist immer etwas das die gesamte Ernährungsweise und nicht die alleinige Zufuhr üblicher Mengen Milchprodukte verschuldet. Auch bei den anderen vorgestellten Nährstoffen leistet Milch einen wichtigen Beitrag der im Falle seiner gezielten Meidung erst einmal auf dieselbe Art und Weise von anderen Lebensmitteln gestemmt werden muss. Sicher keine unlösbare Aufgabe. Aus der Sicht von Nährstoffmengen und Bioverfügbarkeiten spricht jedoch absolut nicht gegen den Einsatz üblicher Mengen an Milch oder Milchprodukten.
Obst und Gemüse
Obst und Gemüse liefern ein breites Spektrum an essentiellen Nährstoffen. Sie tragen darüber hinaus nur vergleichsweise gering zur Energieaufnahme bei. Ein höherer Verzehr von Gemüse und Obst steht für eine geringe Gesamtmortalität oder eine geringere Mortalität durch Herz-Kreislauf-Erkrankungen sowie Krebs (1021,103). Bei nahezu 75% der Weltbevölkerung geht man davon aus, dass sie weniger als die täglich empfohlenen 400 g Gemüse und Obst zu sich nehmen (104). Dieser Umstand schlägt sich schätzungsweise zu 1,8% auf die gesamte globale Krankheitslast nieder (105).
Die vollen Auswirkungen von Obst und Gemüse auf die Gesundheit sieht man in der Wissenschaft als Folge der additiven und synergistischen Wirkungen aller Bestandteile an. Sie sind bekannt als reichhaltige Quelle für Pro-Vitamin-A-Carotinoiden, Vitamin C, Folat, Vitamin K-1, Kalium, Kalzium, Magnesium, Eisen und mehrere andere Spurenelemente (106).
Neben diesen Nährstoffen finden sich auch eine Reihe an nicht-nutritiven bioaktiven Verbindungen in Obst und Gemüse. Zu ihnen zählen Phenole, Carotinoide und Glucosinolate. Wenngleich sie nicht als essentiell für das menschliche Überleben angesehen werden, sagt man ihnen dennoch gesundheitliche Auswirkungen wie z.B. ein verringertes Risiko nichtübertragbarer und degenerativer Krankheiten nach.
Auch der Ballaststoffgehalt in Obst und Gemüse stellt einen wichtigen Ernährungsaspekt dar. Ballaststoffe beeinflussen die Sättigung, die Verarbeitung im Magen-Darm-Trakt, einige Stoffwechselparameter sowie die Zusammensetzung der Darmflora. Ballaststoffe sind in der Lage die Darmgärung zu stimulieren und hierüber die Mineralstoffabsorption zu verbessern (107,108). Auf der anderen Seite können sie die Absorption von Nährstoffen aber auch durch Gelbildung, erhöhte Viskosität oder Bindung und Einschluss negativ beeinflussen (109-111).
Weitere in Gemüse und Obst enthaltene Verbindungen können die menschliche Ernährung und auch Gesundheit negativ beeinflussen. Da wären beispielsweise zu nennen Alkaloide, Oxalate, Phytinsäure, Lektine, Trypsin- und Proteaseinhibitoren, Tannine und Cyanogene. Diese sogenannten Anti-Nährstoffe können durch verschiedene Verfahren wie Fermentierung, Keimung, Kochen, Auslaugen und Extraktion entfernt oder inaktiviert werden (112).
Sehen wir uns nun einmal an, welchen Beitrag Obst und Gemüse für die Versorgung mit Vitaminen und Mineralstoffen leisten.
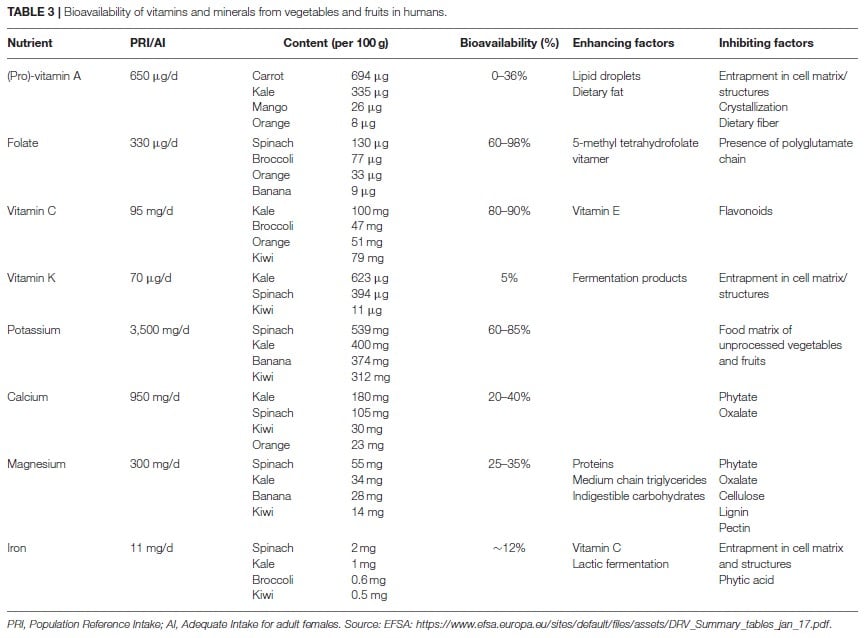
Obst und Gemüse als Quelle für Pro-Vitamin-a-Carotinoide
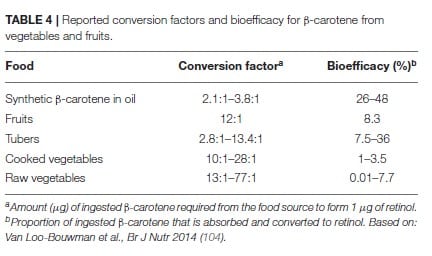
β-Carotin, α-Carotin und β-Cryptoxanthin sind die häufigsten Carotinoide in der Nahrung. Sie werden durch zentrale Spaltung in Vitamin A (Retinol) umgewandelt. B-Carotin kann aufgrund seiner chemischen Struktur doppelt so viel Retinol liefern wie die beiden anderen Carotinoide. Aus diesem Grund, und auch weil es in der Nahrung häufiger vorkommt, konzentriert man sich in der Vitamin-A-Forschung auf β-Carotin. Die Freisetzung von β-Carotin aus der Frucht- oder Gemüsematrix stellt einen der wichtigsten limitierenden Schritte hinsichtlich der Bioverfügbarkeit dar (113, 114).
Grüne Blattgemüse, wie Spinat und Grünkohl, sind reich an β-Carotin. Nur etwa 5 bis 10% des Gesamtgehalts sind jedoch bioverfügbar. Im Gegensatz dazu weist β-Carotin aus Früchten eine höhere Bioverfügbarkeit auf, obwohl der β-Carotingehalt relativ niedrig ausfällt (115,116). Die Erklärung hierfür liegt in der Verdaulichkeit des jeweiligen Pflanzenkompartiments, in dem das β-Carotin gespeichert ist. Insbesondere grünes Blattgemüse speichert β-Carotin in für den Menschen schwer verdaulichen Chloroplasten. β-Carotin aus beispielsweise Mangos wird in Chromoplasten mit besserer Verfügbarkeit gespeichert. Darüber hinaus wird β-Carotin in seiner kristallisierten Form, wie es in Karotten vorkommt, schwer absorbiert. Deutlich besser absorbiert wird β-Carotin in Lipid Tröpfchen wie es beispielsweise die Papaya enthält (115, 116).
Die Menge (μg) an β-Carotin, die erforderlich ist, um 1 μg-Carotin in Retinol zu bilden, wird als Umrechnungsfaktor bezeichnet und auf 2,1 bis 3,8 μg-Carotin geschätzt, sofern es als Zusatz in Öl gelöst zur Verfügung steht. Im Gegensatz zu den früheren Retinol-Äquivalenten (RE), die davon ausgingen, dass die Einnahme von 6 μg β-Carotin 1 μg Retinol ergeben würde, haben aktuelle Erkenntnisse gezeigt, dass die Biokonversionseffizienz für eine durchschnittliche westliche Ernährung viel geringer ausfällt. Daher wurden die neuen Retinol-Aktivitätsäquivalente (RAE) für β-Carotin auf 12:1 festgelegt (105). Die Umwandlungseffizienz von α-Carotin und β-Cryptoxanthin ist kaum untersucht worden, obwohl in letzter Zeit wieder Interesse an letzterem besteht (106, 107). Der Fettgehalt der Nahrung fungiert als wichtigster Förderer der Carotinoid-Absorption (108-110), während in der Nahrung enthaltene Ballaststoffe die Absorptionseffizienz verringern können (118).
Obst und Gemüse als Quelle für Folat
Grünes Blattgemüse und Zitrusfrüchte sind wichtige Nahrungsquellen für Folat. In Gemüse und Früchten liegt Folat meist in seiner polyglutamierten Form vor. Vor der Absorption muss diese enzymatische gespalten werden. Man geht bei polyglutamiertem Folat im Vergleich zu zusätzlicher Folsäure (einem Monoglutamat) von einer Bioverfügbarkeit mit etwa 70% aus (119,120). Andere Studien zeigen, dass es sich bei 5-Methyltetrahydrofolat um die beste natürlich bioverfügbare Form des Vitamins handelt (121). Insgesamt geht man bei Folat aus einer Ernährung mit hohem Gehalt an Obst und Gemüse von einer Bioverfügbarkeit zwischen 60 und 98% aus (105). Hemmende Effekte gehen von der Lebensmittelmatrix, Ballaststoffen sowie einem geringen ph-Wert im Verdauungstrakt aus. Zink ist in der Lage die enzymatische Umwandlung von polyglutamierten Folat zu fördern und steigert über dies seine Resorption (122). Bei diätischen Folat-Äquivalenten geht man davon aus, dass 1,7 μg benötigt werden, um 1 μg Folat in den Körperkreislauf einzubringen (123).

Obst und Gemüse als Quelle für Vitamin C
Bestimmte Früchte wie Kiwi und Orange, aber auch viele Gemüsesorten sind reiche Quellen für Vitamin C. In Hinblick auf die Bioverfügbarkeit geht man sowohl bei der natürlichen Form als auch bei synthetischem Vitamin C von 80 bis 90% aus (124-126). Eine potenzielle Hemmung der Bioverfügbarkeit geht bei Vitamin C von der Lebensmittelmatrix, einem vorzeitigen Abbau oder von der Hemmung durch andere Lebensmittelbestandteile aus. In vitro hemmen Flavonoide die Absorption von Vitamin C. Am lebenden Objekt ist man sich unsicher ob dieser Effekt ebenfalls auftritt (127-129).
Obst und Gemüse als Quelle für Vitamin K
Dunkelgrünes Blattgemüse und Kräuter wie Grünkohl, Petersilie, Spinat und Grünkohl, aber auch Kiwi und Avocado zählen zu den relevanten Quellen an Phylloquinon (Vitamin K1) (130,131). Menachinone (Vitamin K2) kommen im Allgemeinen nicht in Gemüse und Obst vor. Fermentierte Gemüse wie beispielsweise Sauerkraut bilden hier die Ausnahme (130). Obwohl Daten zur Bioverfügbarkeit von Phylloquinon aus Lebensmitteln rar sind, geht man von einer Bioverfügbarkeit unter 5% bei dunkelgrünem Blattgemüse aus. Der Zusatz von Fett oder Ölen hilft dabei, die Bioverfügbarkeit deutlich zu verbessern (132-133). Die geringe Bioverfügbarkeit von Phylloquinon lässt sich über seine Bindung an die Membranen pflanzlicher Chloroplasten erklären (134).

Obst und Gemüse als Quelle für Kalium
Der Verzehr von Gemüse und Obst trägt wesentlich zur Kaliumaufnahme bei. Insbesondere mit dunkelgrünem Blattgemüse und bestimmten Früchten wie Banane oder Kiwi wird Kalium fast vollständig über die Nahrung aufgenommen. Lediglich Matrixeffekte können die Kaliumaufnahme aus unverarbeitetem Gemüse und Obst bis zu einem gewissen Grad behindern. Schätzungen zur Bioverfügbarkeit aus Obst und Gemüse liegen zwischen 60 und 85% (135, 136). Welche Faktoren, die die Absorption von Kalium aus Nahrungsmitteln fördern oder hemmen wurde bis dato nicht hinreichend untersucht (137).
Obst und Gemüse als Quelle für Kalzium
Besonders dunkelgrüne Blattgemüse wie Grünkohl und Spinat tragen zur Kalziumaufnahme über die Nahrung bei. Studien haben gezeigt, dass die Kalziumabsorption aus verschiedenen Gemüsesorten entweder geringer oder vergleichbar mit der Kalziumabsorption aus Milch ausfällt. Die geschätzte Bioverfügbarkeit liegt zwischen 20 und 40% (138-139). Antinährstoffe bestimmen die Effizienz der Kalziumabsorption aus Gemüse. Phytinsäure oder Inositolpolyphosphat sowie Oxalat oder Ethandioat bilden unlösliche, nicht verdauliche Komplexe. Dies begrenzt die Bioverfügbarkeit der Mineralien. Oxalat kommt in hohen Mengen in bestimmten Gemüsesorten wie Spinat, Kohl, Brokkoli, Rosenkohl, Rote Beete und Rhabarber vor.
Obst und Gemüse als Quelle für Magnesium
Magnesium kann in moderaten Mengen aus Obst und Gemüse gewonnen werden. Die Bioverfügbarkeit von Magnesium aus dunkelgrünem Blattgemüse liegt bei 25 bis 35% (140). Oxalat hemmt die Absorption (141). Tatsächlich weist man Oxalat reichem Spinat eine geringere Magnesium-Bioverfügbarkeit verglichen mit weniger Oxalat reichem Grünkohl nach (140). Auch andere Inhibitoren wie Phytinsäure, Zellulose, Lignin und möglicherweise Pektine hemmen die Aufnahme von Magnesium. Proteine, mittelkettige Triglyceride und unverdauliche Kohlenhydrate sind in der Lage die Absorption zu verstärken (142).
Obst und Gemüse als Quelle für Eisen
Grünes Blattgemüse ist reich an Eisen. Die Bioverfügbarkeit fällt mit etwa 12% jedoch relativ gering aus (143). Schuld daran haben unverdauliche zelluläre Komponenten wie Chloroplasten in denen Eisen gespeichert ist (144). Vitamin C ist in der Lage die Bioverfügbarkeit von nicht hämatogenem Eisen anzuheben, indem es entweder seine Löslichkeit verbessert oder als Co-Faktor bei der Reduktion fungiert (145, 146). Phytinsäure fungiert als starker Inhibitor der Eisenabsorption (147), weitaus stärker als Oxalat, welches in einer Studie keinen Einfluss auf die Eisenabsorption aus Grünkohl hatte (148). Eine Humanstudie zeigte, dass die Milchsäuregärung von Gemüse die Eisenabsorption verdoppelt. Saure Bedingungen scheinen das Auftreten der stabileren Eisen(III)-Form im Magen-Darm-Trakt zu fördern (149).
Fazit
Obst und Gemüse unterstützen bei einigen Nährstoffen die Versorgung sehr stark. Bei anderen Nährstoffen haben wir es mit relevanten Nachteilen in Hinblick auf die Bioverfügbarkeit zu tun. Dies begründet sich entweder über die Verdaulichkeit der Pflanzenbestandteile in denen der Nährstoff lagert, oder über die Anwesenheit sogenannter Antinährstoffe die eine Aufnahme erschwert. Zweitgenanntem kann man über die gezielte Verarbeitung der Lebensmittel effektiv begegnen.
Resümee
Wenngleich die Bioverfügbarkeit von Nährstoffen zu den wichtigsten, versorgungsrelevantesten Gegebenheiten zählt, weiß man zum heutigen Tage bei weitem noch nicht von jedem Nährstoff wie er aus welcher Quelle vom Menschen aufgenommen wird. Ebenso ist man sich noch nicht im Klaren darüber, welche Wechselwirkungen bei der Aufnahme gemischter Lebensmittel im Rahmen einer Mahlzeit entstehen. Individuelle Gegebenheiten wie der Nährstoffstatus, der Krankheitszustand oder die Genetik spielen ebenfalls eine Rolle.
Zwei Dinge lassen sich aber dennoch aus dem heutigen Beitrag ableiten:
- Der gesundheitliche Nutzen von Lebensmitteln erklärt sich durch additive, antagonistische und synergistische Prozesse auf der Ebene von Aufnahme und Absorption an Nährstoffen
- Sowohl Milchprodukte als Stellvertreter für tierische Nahrungsbestanteile, also auch Obst und Gemüse liefern einen wertvollen Beitrag zur vollumfassenden Versorgung mit Nährstoffen. Sie ergänzen sich einerseits. Andererseits kann die eine Kategorie nicht ohne weiteres die andere vollumfänglich ersetzen. Diese Tatsache spiegelt den Stellenwert einer bewusst omnivoren Kost verglichen mit einseitigeren Modellen klar wieder, egal ob in Richtung karnivore oder vegane Ernährung.
Sportliche Grüße

Quellen
(1)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7400927/
(2)
https://www.tandfonline.com/doi/full/10.1080/07315724.2020.1770636
(3)
https://drc.bmj.com/content/8/1/e000826
(4)
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(18)31812-9/fulltext
(5)
(6)
https://www.ncbi.nlm.nih.gov/pubmed/20392703
(7)
https://academic.oup.com/advances/article/10/5/917S/5569504
(7)
https://pubmed.ncbi.nlm.nih.gov/31075788/
(8)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6518123/
(9)
https://pubmed.ncbi.nlm.nih.gov/30839054/
(10)
https://onlinelibrary.wiley.com/doi/full/10.1002/mnfr.202000319
(11)
https://pubmed.ncbi.nlm.nih.gov/32277831/
(12)
https://www.bmj.com/content/367/bmj.l6204
(13)
https://pubmed.ncbi.nlm.nih.gov/31192363/
(14)
https://pubmed.ncbi.nlm.nih.gov/31435641/
(15)
https://pubmed.ncbi.nlm.nih.gov/25352269/
(16)
https://www.eurekalert.org/pub_releases/2018-09/tl-tld091018.php
(17)
https://pubmed.ncbi.nlm.nih.gov/30595374/
(18)
https://academic.oup.com/ajcn/article-abstract/111/5/944/5812914?redirectedFrom=fulltext
(19)
https://www.mdpi.com/2072-6643/12/9/2720
(20)
https://www.tandfonline.com/doi/full/10.1080/19490976.2020.1799533
(21)
https://www.sciencedirect.com/science/article/abs/pii/S0939475320300442
(22)
https://www.frontiersin.org/articles/10.3389/fnut.2020.00097/full
(23)
(24)
https://pubmed.ncbi.nlm.nih.gov/32520346/
(25)
https://pubmed.ncbi.nlm.nih.gov/32398755/
(26)
(27)
https://pubmed.ncbi.nlm.nih.gov/31584063/
(28)
https://www.nejm.org/doi/pdf/10.1056/NEJMra1903547?articleTools=true
(29)
https://europepmc.org/article/med/17521121
(30)
https://academic.oup.com/ajcn/article/94/2/691S/4597990
(31)
https://pubmed.ncbi.nlm.nih.gov/16711470/
(32)
https://www.frontiersin.org/articles/10.3389/fphys.2012.00317/full
(33)
(34)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2011.10719986
(35)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2011.10719985
(36)
(37)
https://www.mdpi.com/2072-6643/9/7/697
(38)
https://www.mdpi.com/2072-6643/10/7/874
(39)
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0189230
(40)
https://www.frontiersin.org/articles/10.3389/fnut.2019.00093/full
(41)
https://www.mdpi.com/2072-6643/11/8/1771
(42)
https://academic.oup.com/ajcn/article/77/6/1352/4689829
(43)
https://www.sciencedirect.com/science/article/pii/S1043452617300384?via%3Dihub
(44)
https://www.mdpi.com/2072-6643/11/8/1948
(45)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2000.10718083
(46)
https://www.sciencedirect.com/science/article/abs/pii/S0273230003001430?via%3Dihub
(47)
https://www.springer.com/de/book/9781447114390
(48)
https://asbmr.onlinelibrary.wiley.com/doi/abs/10.1002/jbmr.5650040404
(49)
https://link.springer.com/article/10.1007/s11657-020-0694-y
(50)
https://www.annualreviews.org/doi/10.1146/annurev.nu.04.070184.002351
(51)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2000.10718083
(52)
https://www.sciencedirect.com/science/article/abs/pii/S0308814613014155?via%3Dihub
(53)
(54)
https://pubmed.ncbi.nlm.nih.gov/2697231/
(55)
https://academic.oup.com/jn/article-abstract/122/suppl_3/641/4755264?redirectedFrom=fulltext
(56)
https://www.sciencedirect.com/science/article/abs/pii/0016508583901944
(57)
https://journals.physiology.org/doi/abs/10.1152/ajpgi.1981.240.1.G32
(58)
https://academic.oup.com/jn/article/126/5/1406/4722794
(59)
https://www.tandfonline.com/doi/abs/10.1080/07315724.1991.10718137
(60)
https://academic.oup.com/ajcn/article/76/2/442/4689526
(61)
https://pubmed.ncbi.nlm.nih.gov/12197838/
(62)
(63)
https://www.mdpi.com/2072-6643/11/4/718
(64)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2000.10718083
(65)
https://link.springer.com/article/10.1007%2Fs00198-018-4534-5
(66)
https://www.tandfonline.com/doi/full/10.1080/07315724.2013.816604
(67)
https://academic.oup.com/ajcn/article-abstract/35/4/783/4812547?redirectedFrom=fulltext
(68)
https://www.tandfonline.com/doi/abs/10.1080/07315724.2000.10718083
(69)
https://nyaspubs.onlinelibrary.wiley.com/doi/10.1111/nyas.12300
(70)
https://nyaspubs.onlinelibrary.wiley.com/doi/10.1111/nyas.12300
(71)
https://academic.oup.com/nutritionreviews/article/70/6/311/1846932
(72)
https://academic.oup.com/ajcn/article-abstract/41/2/254/4691642?redirectedFrom=fulltext
(73)
https://link.springer.com/article/10.1007%2Fs00394-006-0612-0
(74)
https://link.springer.com/article/10.1007%2Fs00394-006-0612-0
(75)
https://academic.oup.com/ajcn/article/77/6/1352/4689829
(76)
https://academic.oup.com/ajcn/article/85/6/1557/4633061
(77)
https://academic.oup.com/nutritionreviews/article/73/2/106/1820655
(78)
https://www.journalofdairyscience.org/article/S0022-0302(19)30292-9/fulltext
(79)
https://academic.oup.com/jn/article/131/2/291/4687022
(80)
https://www.karger.com/Article/FullText/346968
(81)
https://www.mdpi.com/2072-6643/11/10/2382
(82)
https://academic.oup.com/jn/article/134/11/3100/4688389
(83)
https://www.nmcd-journal.com/article/S0939-4753(08)00209-3/fulltext
(84)
https://academic.oup.com/cdn/article/1/6/e000638/4558638
(85)
https://www.mdpi.com/2072-6643/10/4/446
(86)
https://www.nature.com/articles/ejcn20163
(87)
https://academic.oup.com/advances/article/4/4/463/4259633
(88)
https://academic.oup.com/nutritionreviews/article/75/7/553/3859571
(89)
https://www.jrnjournal.org/article/S1051-2276(16)30097-8/fulltext
(90)
https://academic.oup.com/jn/article-abstract/149/5/816/5481518?redirectedFrom=fulltext
(91)
(92)
https://academic.oup.com/jn/article/147/6/1086/4669672
(93)
https://jamanetwork.com/journals/jamapediatrics/article-abstract/511049
(94)
https://academic.oup.com/jn/article/130/5/1378S/4686381
(95)
https://onlinelibrary.wiley.com/doi/10.1002/1521-3803(20001201)44:6%3C390::AID-FOOD390%3E3.0.CO;2-Y
(96)
(97)
(98)
(99)
https://www.sciencedirect.com/science/article/abs/pii/S1521690X17301021?via%3Dihub
(100)
https://www.sciencedirect.com/science/article/pii/S0946672X18304528?via%3Dihub
(101)
https://academic.oup.com/ajcn/article-abstract/110/1/102/5524531?redirectedFrom=fulltext
(102)
https://academic.oup.com/ije/article/46/3/1029/3039477
(103)
https://www.bmj.com/content/349/bmj.g4490
(104)
https://www.ajpmonline.org/article/S0749-3797(09)00097-X/fulltext
(105)
https://pubmed.ncbi.nlm.nih.gov/15744402/
(106)
https://www.mdpi.com/2072-6643/7/6/4593
(107)
(108)
https://academic.oup.com/ajcn/article/105/1/10/4569848
(109)
https://academic.oup.com/jn/article/129/12/2170/4722118
(110)
https://academic.oup.com/nutritionreviews/article/72/7/429/1825007
(111)
https://www.eurekaselect.com/83443/article
(112)
https://link.springer.com/chapter/10.1007%2F978-1-4899-2626-5_33
(113)
https://academic.oup.com/jn/article/129/2/349/4731677
(114)
(115)
https://www.sciencedirect.com/science/article/abs/pii/S0308814612011478?via%3Dihub
(116)
(117)
https://doi.org/10.1093/ajcn/nqaa301
(118)
(119)
https://academic.oup.com/ajcn/article/84/5/1128/4649047
(120)
https://academic.oup.com/ajcn/article/79/3/424/4690134
(121)
https://link.springer.com/article/10.2165/11532990-000000000-00000
(122)
https://library.wur.nl/WebQuery/wda/abstract/1690224
(123)
https://www.ncbi.nlm.nih.gov/books/NBK114310/
(124)
https://www.nature.com/articles/278737a0
(125)
https://www.mdpi.com/2072-6643/5/11/4284
(126)
https://onlinelibrary.wiley.com/doi/full/10.1111/odi.12446
(127)
https://www.jbc.org/content/277/18/15252
(128)
https://www.jbc.org/content/280/7/5211
(129)
https://academic.oup.com/jn/article/130/5/1297/4686545
(130)
https://www.mdpi.com/1422-0067/20/4/896
(131)
https://pubmed.ncbi.nlm.nih.gov/10858697/
(132)
https://pubmed.ncbi.nlm.nih.gov/8813897/
(133)
https://pubmed.ncbi.nlm.nih.gov/20420753/
(134)
(135)
https://www.tandfonline.com/doi/full/10.1080/09637480701690519
(136)
https://academic.oup.com/ajcn/article/104/2/346/4564569
(137)
https://www.mdpi.com/2072-6643/8/7/444
(138)
https://academic.oup.com/ajcn/article-abstract/51/4/656/4695196?redirectedFrom=fulltext
(139)
https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1750-3841.2008.00949.x
(140)
(141)
https://www.eurekaselect.com/151969/article
(142)
https://www.eurekaselect.com/151969/article
(143)
https://academic.oup.com/jn/article/44/3/383/4727580
(144)
https://www.sciencedirect.com/science/article/abs/pii/S0308814600002363?via%3Dihub
(145)
https://www.mdpi.com/2072-6643/7/4/2274
(146)
https://pubmed.ncbi.nlm.nih.gov/3700141/
(147)
https://academic.oup.com/ajcn/article-abstract/49/1/140/4716267?redirectedFrom=fulltext
(148)
https://www.nature.com/articles/1602721
(149)
https://link.springer.com/article/10.1007%2Fs00394-015-0857-6
(150)