Eiprotein – Sollte ich es regelmäßig essen? Body-Coaches ist bekannt für die wissenschaftliche Aufarbeitung von Themen aber auch dafür, sich allem gegenüber eine gewisse Grundskepsis zu bewahren. Ein Thema, mit dem sich die Schulmedizin nicht rühmen kann, ist der Umgang mit dem guten alten Hühnerei als Lebensmittel einer gesundheitsorientierten Kost. Meist wegen seines Gehalts an Cholesterin wurde und wird es auch heute noch völlig kontrovers und ohne erkennbaren Konsens in der Wissenschaft diskutiert. Es ist ein wilder Dschungel an Meinungen und Thesen.
Fest steht, dass Dysregulationen bei Lipidmarkern niemals allein auf die Verwendung eines Lebensmittels in üblichen Mengen zurückzuführen sind, das gilt auch für die Rolle des Hühnereis bei Cholesterinwerten (1-5). Im Gegenzug enthalten Eier mehrere Nährstoffkomponenten, die vor chronischen Krankheiten schützen, darunter Lutein, Zeaxanthin, Colin, Vitamin D, Selen und Vitamin A (6). Eine Frage, die viel zu selten gestellt wird, ist die, inwieweit es sich bei Hühnereiweiß alias Eiprotein um einen besonderen und wertvollen Nahrungsbestandteil handelt. Dies wollen wir heute einmal beantworten.

Eiprotein – Die Basics
Es ist allgemein bekannt, dass Eier eine der besten Nahrungsquellen für hochwertiges Eiweiß sind. Sie enthalten alle essenziellen Aminosäuren und sind für ihre hohe biologische Wertigkeit bekannt [7]. In der Tat gelten Eier als die perfekte Proteinquelle und dienen daher als Referenzprotein für den Vergleich mit anderen Eiweißquellen [8].
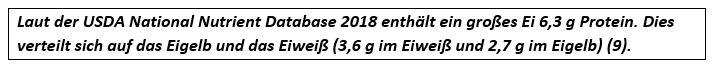
Proteine aus Eiklar und Eigelb unterscheiden sich in deren Zusammensetzung und Funktion (9). So bindet Ovotransferrin in Eiklar Metallionen, Ovomucin hat antivirale Eigenschaften und Lysozym spaltet die Zellwände spezieller Bakterien (6). Lipovitellin als HDL-Unterfraktion im Eigelb sowie Phosvitin schützen vor Lipidoxidation in dem sie Schwermetalle binden (8).
Beachtet werden muss, dass Ei-Allergien wie man sie hier und da bei Kindern feststellt (10), hauptsächlich auf im Eiweiß enthaltene Proteine zurückzuführen sind (11). Für alle nicht Betroffenen birgt Eiprotein eine Reihe gesundheitlicher Vorteile. In den folgenden Kapiteln gehen wir auf seine Rolle zur Unterstützung der Skelettmuskelsynthese, zum Schutz vor Sarkopenie, zur Verringerung des Appetits, zur Verhinderung von Eiweißmangel sowie für ein normales Wachstum von Kindern ein.
Fazit
Eiprotein liefert neben einer hohen Menge an essenziellen in einem guten Verhältnis zueinander zudem eine Reihe zusätzlicher Proteine mit spezifischen Eigenschaften. Das Protein aus Eigelb und Eiklar sind dabei nicht identisch in deren Bestandteilen.
Eiprotein und Prävention von Unterernährung bei Kindern
Wie bereits erwähnt, enthalten Eier viele Nährstoffe und bioaktive Komponenten, die zur Vorbeugung chronischer Krankheiten beitragen können, darunter auch Eiweiß. Die Proteinqualität wird anhand des Proteinverdaulichkeits-korrigierten Aminosäurescore
(PDCAAS) bewertet; je höher der Wert des PDCAAS, desto besser erfüllt das Protein die Anforderungen an alle essenziellen Aminosäuren in Bezug auf Menge und Verdaulichkeit (12).
Bezogen auf die Anforderungen von Kindern im Alter von 6 Monaten bis 5 Jahren liegt der PDCAAS-Wert für Eier bei 118 %, verglichen mit 92 bis 94 % für Fleisch und Fisch, 90 bis 93 % für Soja und 35 bis 57 % für Cerealien einschließlich Reis, Weizen und Mais (12).
Eiprotein ist verglichen mit anderen hochwertigen Eiweißquellen verhältnismäßig preiswert und darum auch für niedrige sozioökonomische Gruppen erschwinglich (13). Zwar enthält Eiklar Protease-Inhibitoren, die die Verdaulichkeit der Aminosäuren verringern können (14), diese können jedoch leicht durch Hitze zerstört werden. Ein Punkt, auf den wir später nochmals eingehen werden, der aber prinzipiell gekochtes oder erhitztes Hühnereiweiß als besser verfügbare Proteinquelle vor rohem Eiprotein rechtfertigt.
Die Welt geht mit dem Einsatz von Eiern als Bestandteil der Ernährung von Kindern völlig unterschiedlich um. So finden sich Eier in Lateinamerika häufiger auf dem Speiseplan von Kleinkindern als in asiatischen oder afrikanischen Ländern (15). In Nepal verbietet offenbar die Religion die Verwendung von Eiern (16), während in Äthiopien Eier als wichtige Nahrungsquelle für die körperliche und geistige Entwicklung der Kinder angesehen werden (17). In unterentwickelten Ländern sorgt die generelle Abstinenz von Eiern sowie anderen eiweißreichen Eiweißquellen zur Ausbildung einer Form von Mangelernährung, die sich Kwashiorkor nennt (18). Auf der anderen Seite kann die Einbindung von Eiern in den Speiseplan von Kleinkindern die Zahl auftretender Fälle von Kwashiorkor verringern (19). Werden von stillenden Müttern regelmäßig Eier verzehrt, kann dies die Zusammensetzung der Nährstoffe in der Muttermilch positiv beeinflussen und die Entwicklung des gestillten Kindes fördern [20]. In Ecuador stellten Iannotti et al (22) bei Kindern die über 6 Monate täglich ein Ei verzehrten verglichen mit einer Kontrollgruppe ein 74% geringeres Aufkommen von Untergewicht und ein 47% geringeres Risiko von Stunting. Man versteht darunter eine Art der Mangelernährung, die sich in einem Zurückbleiben der körperlichen und geistigen Entwicklung von Kindern äußert. Pirkwieser et al (120) konnten zeigen, dass der tägliche Verzehr sprühgetrockneter Eier im Äquivalent eines mittelgroßen Hühnereis 100% des Bedarfs für Vitamin E, 24% für Retinol, 61% für Selen und 22% für Zink bei Kindern abdeckt.
Eine Reihe von Kampagnen und Programmen wurden in verschiedenen Ländern der Welt gestartet, um den Verzehr von Eiern bei Kindern zu erhöhen und über seine Vorteile aufzuklären (20,23,28).
Fazit
Insgesamt scheint gut nachgewiesen zu sein, dass ein gewisser Konsum von Eiern eine Unterernährung bei Kindern verhindert und die Entwicklung fördert.

Eiprotein und die Gesundheit der Skelettmuskulatur
Bedeutung von Skelettmuskulatur
Muskulatur ist grundsätzlich etwas äußerst Erstrebenswertes (29,30). Nebst der Tatsache das wir sie zur Mobilisierung passiver Bewegungsstrukturen benötigen (32), verbessert sie auch die Insulinsensibilität (31), verringert das Risiko auf Hypertonie und andere Erkrankungen des Herz-Kreislaufsystems (30,33) sowie die Entstehung von Osteoporose. Letztlich wirkt sich der Anteil an Skelettmuskulatur auf die Gesamtsterblichkeit aus (34).
Protein und Krafttraining für mehr Skelettmuskulatur
Die Kombination aus Krafttraining mit seinem Hypertrophie-Effekt sowie ausreichend Protein für einen verbesserten Proteinstoffwechsel ist in der Lage, Muskelmasse in Aufbauphasen zu unterstützen und ebenso Muskelabbau in Diätphasen sowie altersbedingt im Rahmen von Erscheinungen wie Sarkopenie entgegenzuwirken (35,114). Mit „ausreichend“ Protein ist damit nicht eine Menge von 0,8g pro Kilogramm Körpergewicht gemeint die in der Theorie ausreicht, um ein Gleichgewicht in der Stickstoffbilanz herzustellen. Sowohl für sportlich engagierte Menschen, für ältere Zeitgenossen aber auch Personen, die Wert auf eine optimale Muskelfunktion legen, sind diese Mengen an täglichem Protein zu wenig (35,115,116). Experten raten zu einer Proteinaufnahme von 1,4 bis 2,0g pro Kilogramm Körpergewicht, sowie nochmals erhöhten Mengen in Energie defizitären Phasen (36,37). Solche Mengen versprechen einerseits bessere Effekte, ohne auf der anderen Seite negative Auswirkungen auf abbauende Organe wie die Nieren auszuüben (37,38,39).

Vorteil von Eiprotein als Proteinquelle
Ein großes Ei liefert etwa 72 Kalorien und etwa 6,3g hochwertiges Eiweiß (40). Eier bieten damit eine einfache, kostengünstige und verhältnismäßig niedrig-kalorische Option zur Versorgung mit hochwertigem Protein. Letztgenannte Eigenschaft der hohen biologischen Wertigkeit kommt dann zu tragen, wenn nicht im Übermaß zugeführte Mengen an Protein den bestmöglichen Ausgleich im Proteinstoffwechsel herstellen sollen. Hierzu bedarf es der Verfügbarkeit insbesondere essenzieller Aminosäuren in einer sinnvollen Gewichtung, einer gewissen Menge an Leucin aber auch einer guten Verdaulichkeit (41).
All diese Anforderungen erfüllt Eiprotein. Eine davon ist der Leucin-Gehalt. Dieser liegt bei etwa 500mg pro Ei. Jäger et al (117) definieren eine Menge von 700 bis 3000mg Leucin pro Portion als notwendig für das Proteinsynthese-Stimulus-Maximum.
Ein Ei pro Portion würde also nicht genügen. Mit einer moderaten Menge ab 2 Eiern pro Portion wäre man theoretisch bereits im unteren Bereich des Leucin-Solls, allerdings erfüllt man auch damit noch nicht das Optimum bei Gesamtprotein sowie dem Gehalt an essenziellen Aminosäuren pro Portion.
Neben Fleisch und Milchprodukten darf man auch bei Eiern von einer Proteinverdaulichkeit über 90% ausgehen. Der WHO zur Folge ist das Ei mit 97% Verdaulichkeit Spitzenreiter, gefolgt von Milchprodukten (95%) und Fleisch (94%) (43). Schlechter hingegen sieht es bei pflanzlichen Proteinen mit einer Verdaulichkeit im Bereich von 45 und 80% (42). Soja- und Weizenprotein werden dazu in höherem Maße in Harnstoff umgewandelt, was die Netto-Menge an Protein für die Proteinsynthese weiter reduziert (44).
Das sagen Studien
Spezifische Forschung zu den Auswirkungen von Eiern auf die Muskelproteinsynthese und weiterführend Muskelaufbau ist leider begrenzt.
- Moore (46) und Witard (47) stellen in deren Studien fest, dass 20g Eiprotein die Muskelproteinsynthese optimal stimulieren. Hida et al (48) stellten mit Verabreichung von 15g Eiprotein zu einer Ernährung mit 1,08g Protein pro Kilogramm Körpergewicht und Training keine merklichen Einflüsse auf Aminosäurekonzentrationen, fettfreie Masse und Kraft binnen 8 Wochen, verglichen mit einem Kohlenhydrat-Placebo fest. Ein Zeichen dafür, dass es auch bei Eiprotein auf eine entsprechende Menge pro Portion ankommt, um Effekt zu bewerkstelligen.
- Iglay et al (49) untersuchten die Verabreichung einer eiweißreichen Ernährung mit Eiern als Hauptproteinquelle (1,2g/kg/kg), verglichen diese mit einer eiweißärmeren Kost und stellen ebenfalls keine positiven Veränderungen von Skelettmuskelmasse oder Körperzusammensetzung fest. Ein Zeichen dafür, dass man auch mit Eiprotein insgesamt eine Menge von mindestens 1,4g pro Kilogramm Körpergewicht zu sich nehmen sollte.
- Stimmen die Parameter Gesamtproteinaufnahme (1,5g/kg/kg) und Menge pro Portion (20g), ergeben sich wie bei Bagheri et al (51,52) positive Effekte aus einer Verabreichung von Eiprotein auf Kraftwerte, Körperzusammensetzung und Konzentrationen bei Testosteron.
- Wright et al (83) verabreichten älteren Probanden allerdings ohne zeitgleiches Krafttraining mehr Protein über Eier morgens (18,9g) uns als Snack (6,3g) und erzielten damit neben einem Gewichtsverlust gleichzeitig Muskelerhalt trotz der Mehraufnahme an Kalorien über besagte Eier verglichen mit der Kontrollgruppe. Der Verzehr von Eiern förderte insgesamt die Aufnahme der empfohlenen Proteinmenge zur Maximierung der Proteinsynthese.
- Garrido-Miguel et al (119) stellten den Verzehr von Eiern in den Kontext zu Markern der Körperzusammensetzung wie BMI, Körperfett oder fettfreie Masse. Wie sich zeigte, sorgte der höchste Verzehr von Eiern (5 oder mehr pro Woche) verglichen mit dem Verzehr von weniger als einem Ei pro Woche für geringere Werte bei BMI sowie Körperfett und gleichzeitig für mehr fettfreie Masse. Die Forscher sehen insbesondere die über den Eierverzehr herbeigeführte vermehrte Proteinaufnahme als maßgeblichen Grund für diese Beobachtung.
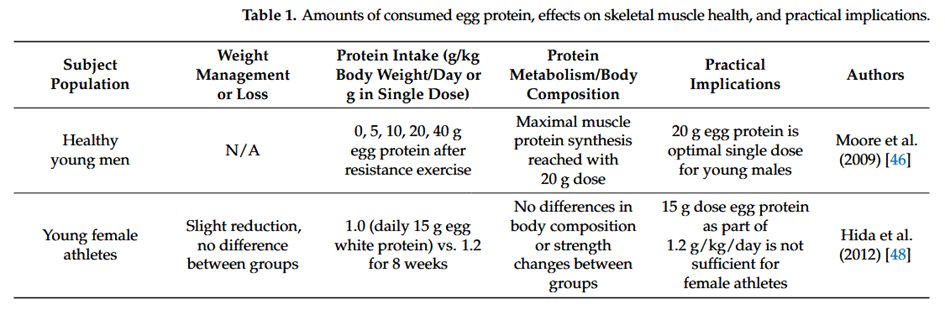
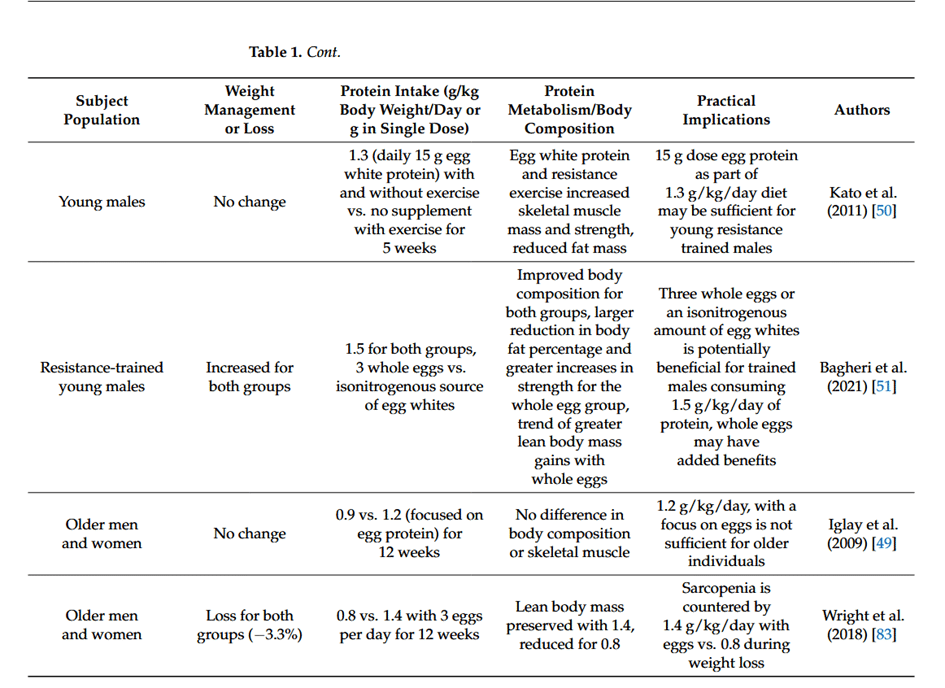
Studien zu Eiprotein und seinem Effekt auf den Proteinstoffwechsel sowie die Körperzusammensetzung im Überblick:
Ganzes Ei oder nur Eiklar?
Spannend für die Praxis erscheint Tatsache, dass sich im Eigelb etwa 40% des gesamten Proteingehalts eines Hühnereis befinden. Der Verzehr ganzer Eier anstelle von nur Eiklar kann Van Vliet (58) und Bagheri (51) zur Folge auch eine stärkere Stimulation der myofibrillären Proteinsynthese nach dem Krafttraining begünstigen. Man vermutet das spezifische Bestandteile im Eigelb wie Phospholipide, miroRNAs oder Mikronährstoffe für die Unterschiede verantwortlich sind (59,60).

Roh oder erhitzt?
In alten Zeiten von Arnold und Rocky wurden Eier noch morgens in den „Smoothie“ gepackt, und zwar roh! Der perfekte Start in den Tag! Eine neue Studie (118) wollte wissen, ob diese Taktik sinnvoll ist. Zu diesem Zweck untersuchten sie an 54 jungen, krafttrainierten Probanden die Effekte von einmal einem Kontrollfrühstück mit 5g Protein, 30g Protein verabreicht über 5 rohe Eier und 30g Protein verabreicht über gekochte Eier auf den Aminosäure- und Proteinstoffwechsel nach einer standardisierten Ganzkörperkrafttrainingseinheit.
Wie sich zeigte, beeinträchtige die Zufuhr von Hühnerei-Protein in rohem Zustand den postprandialen Anstieg der Aminosäuren im Blut. Der hierüber resultierende Einfluss auf die myofibrilläre Proteinsynthese über 5 Stunden nach der Aufnahme zeigt jedoch keinen signifikanten Unterschied.
Denaturierung durch Kochen fördert die Verdaulichkeit von Eiprotein, in dem es die Arbeit von Verdauungsenzymen erleichtert und gleichzeitig verschiedene Trypsin-Inhibitoren inaktiviert.
Ausbleibende Unterschiede auf die Muskelproteinsynthese-Rate nach dem Training können sich die Forscher nicht klar erklären. Vermutlich war mit 30g Protein schon die notwendige Menge von etwa 30g hochwertigem Protein zur Maximierung der Proteinsynthese bei jungen Trainierenden erreicht. Werden also geringe Mengen verabreicht, kämen die Unterschiede in der Aufnahme und Beeinflussung von Plasma-Spiegels aller Wahrscheinlichkeit nach auch in der Auswirkung auf die Proteinsynthese zu tragen.
Fazit
Skelettmuskulatur erfüllt weit mehr wichtige Aufgaben in unserem Körper als nur das Gewährleisten einer sportlichen Optik. Neben dem Erhalt der Mobilität übernimmt sie zudem metabolische Funktionen und wirkt sich neben der Knochengesundheit auch auf die Gesamtsterblichkeit aus. Für optimale Eigenschaften von Skelettmuskulatur in Sachen Aufkommen und Funktion sind gewisse regelmäßige Aufnahmemengen an Protein unabdingbar. Die Art und Weise der Aufnahme von Protein spielt auch eine Rolle. Hier schneidet Eiprotein in der Theorie mit Bestnoten bei der Wertigkeit und auch Verdaulichkeit ab. In der Praxis existieren leider nicht sehr viele spezifische Studien zur Verwendung von Eiprotein. Für die Praxis erscheint die Tatsache eines besseren Einflusses auf die Proteinsynthese, wenn komplette Eier anstelle von nur Eiklar verwendet werden. Ebenso bedeutet es einen gewissen Vorteil in der Verdaulichkeit, wenn Eiprotein nicht roh, sondern erhitzt verzehrt wird.
Eiprotein, Immunität und Schutz vor chronischen Krankheiten
Antimikrobielle und immunologische Effekte von Eiprotein erfüllen einen potenziell therapeutischen Nutzen (9). Substanzen wie Immunglobulin IgY als Äquivalent zum menschlichen IgG, Avidin, Phosvitin, Lysozym, Ovotransferrin oder hydrolysierte Eiproteine zeigen in Studien an Menschen und Tieren spannende Effekte gegen bestimmte pathogene Bakterien, bei entzündlichen Darmerkrankungen oder aber zur Senkung des Blutdrucks (9,88-104).
Eiprotein, Sättigung und Gewichtsreduktion
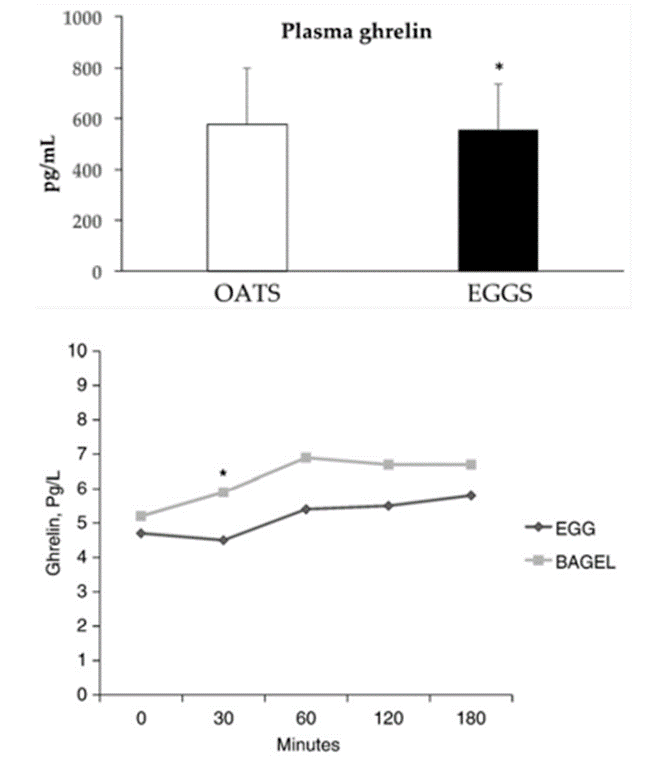
Gewichtsreduktion über den Ast einer besseren Sättigung stellt in der heutigen Zeit mit steigenden Zahlen fettleibiger Menschen einen wichtigen Aspekt für Gesundheit und auch zur Kostenkontrolle im Gesundheitssystem dar (105). Diskutiert wird über Vorteile von Lebensmitteln mit einem hohen Sättigungs-Index (106) oder aber von solchen die in der Lage sind, das Hungerhormon Ghrelin zu unterdrücken (107). Eier erfüllen diese Voraussetzungen, indem sie nachweislich den Appetit reduzieren und den Ghrelin-Spiegel senken (108,109). Im Vergleich eines Frühstücks basierend auf Kohlenhydraten wie Haferflocken oder auch Bagels lässt sich mit Eiern in Studien eine verbesserte Appetitunterdrückung zeitgleich mit geringeren Auswirkungen auf Plasmaglukose und Insulin sowie eine deutlichere Absenkung von Ghrelin nachweisen (108-110). Werden Eier ins Frühstück integriert, sorgt dies für ein höheres Sättigungsempfinden mit positiven Veränderungen bei Körpergewicht, Körperfettgehalt und Taillenumfang ohne signifikante Veränderungen des Blutcholesterinspiegels (111-112). Bei Rueda et al (113) konnte ein solch positiver Unterschied nicht aufgezeigt werden, allerdings sorgten auch hier 400mg mehr aufgenommenes Cholesterin aus Eiern nicht für signifikante Veränderungen bei Plasmacholesterin. Direkte Effekte auf BMI und Körperfett mit erhöhtem Eierverzehr (≥5 eggs/week) und dem damit verbundenen erhöhtem Aufkommen an Nahrungsprotein stellt die oben bereits vorgestellte Studie von Garrido-Miguiel et al (119) fest.
Fazit
Eier eignen sich hervorragend zur Appetitkontrolle. Möglich wird dies über deren Einfluss auf die Sättigung sowie auf gewisse appetitfördernde Signalgeber. Insgesamt eignen sich Eier hervorragend als „Diet-Food“ für die Zielsetzung Gewichtsreduzierung.
Resümee
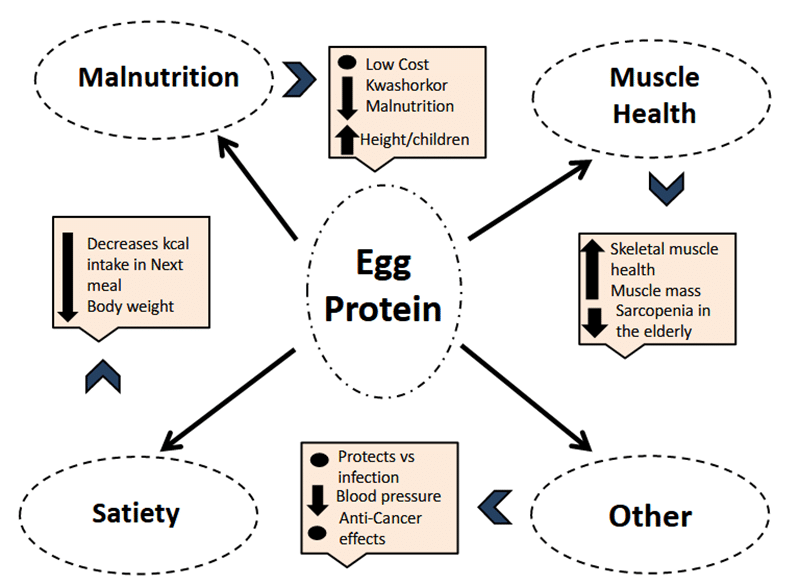
Bei Eiern überwiegen die positiven Effekte aus allen enthaltenen Substanzen bei weitem gegenüber Nachteilen, wie beispielsweise einer potenziell negativen Beeinflussung des Cholesterinaufkommens. Schon im Kindesalter lässt sich ein starker Nutzen für einen guten Nährstoffstatus sowie eine normale Entwicklung nachweisen. Im weiteren Verlauf des Lebens ist Eiprotein maßgeblich am Aufbau sowie Erhalt von Skelettmuskultur beteiligt und damit an einer Einrichtung mit lebensnotwendigen Funktionen. Weitere Einflüsse von Eiprotein auf den Blutdruck, die Immunfunktion sowie das Appetitverhalten sind in der verfügbaren Literatur dokumentiert.
Insgesamt gibt es keinen Grund, Eier nicht als feststehenden Teil einer gesunden Ernährung in einer angemessenen Menge regelmäßig zu empfehlen und auf Eiprotein als besonders wertvolle Quelle für Eiweiß hinzuweisen.
Wir freuen uns auf Feedback von euch zum Thema Eiprotein!
Sportlicher Gruß
Holger Gugg
Quellen
(1)
U.S. Department of Health and Human Services and U.S. Department of Agriculture. Available online: http://health.gov/dietaryguidelines/2015/ (accessed on 14 June 2022).
(2)
Herron, K.L.; Vega-Lopez, S.; Conde, K.; Ramjiganesh, T.; Shachter, N.S.; Fernandez, M.L. Men classified as hypo- or hyperresponders to dietary cholesterol feeding exhibit differences in lipoprotein metabolism. J. Nutr. 2003, 133, 1036–1042.
(3)
DiMarco, D.D.; Barona, J.; Fernandez, M.L. Dietary cholesterol affects plasma lipid levels, the intravascular processing of lipoproteins and reverse cholesterol transport without increasing the risk for heart disease. Nutrients 2012, 4, 1015–1025.
(4)
Blesso, C.N.; Andersen, C.J.; Barona, J.; Volek, J.S.; Fernandez, M.L. Whole egg consumption improves lipoprotein profiles and insulin sensitivity to a greater extent than yolk-free egg substitute in individuals with metabolic syndrome. Metabolism 2013, 62,400–410.
(5)
Ballesteros, M.N.; Valenzuela, F.; Robles, A.E.; Artalejo, E.; Aguilar, D.; Andersen, C.J.; Valdez, H.; Fernandez, M.L. One egg per day improves inflammation when compared to an oatmeal-based breakfast without increasing other cardiometabolic risk factors in diabetic patients. Nutrients 2015, 7, 3449–3463.
(6)
Fernandez, M.L. Effects of eggs on plasma lipoproteins in healthy populations. Food Funct. 2010, 1, 156–160.
(7)
Kovas-Nolan, J.; Phillips, M.; Mine, Y. Advances in the value of eggs and egg components for human health. J. Agric. Food Chem. 2005, 53, 8421–8431.
(8)
Dubin, S.; McKee, K.; Battish, S. Essential amino acid reference profile affects the evaluation of enteral feeding products. J. Am. Diet Assoc. 1994, 94, 884–887. [CrossRef]
(9)
Fernandez, M.L.; Andersen, C.J. Eggs, Composition and Health. In Encyclopedia of Food and Health; Finglas, P.M., Toldra, F., Caballero, B., Eds.; Elsevier: Amsterdam, The Netherlands, 2015; pp. 470–475.
(10)
Rona, R.J.; Keil, T.; Summers, C.; Gislason, D.; Zuidmeer, L.; Sodergren, E.; Sigurdardottir, S.T.; Lindner, T.; Goldhahn, K.; Dahlstrom, J.; et al. The prevalence of food allergy: A meta-analysis. J. Allergy Clin. Immunol. 2007, 120, 638–646.
(11)
Réhault-Godbert, S.; Guyot, N.; Nys, Y. The Golden Egg: Nutritional Value, Bioactivities, and Emerging Benefits for Human Health. Nutrients 2019, 11, 684. [CrossRef]
(12)
Tome, D. Criteria and markers for protein quality assessment-A review. Br. J. Nutr. 2012, 108, S222–S229.
(13)
Drewnowski, A. The nutrient rich food index helps to identify healthy, affordable foods. Am. J. Clin. Nutr. 2010, 91, 1095S–1110S. [CrossRef] [PubMed]
(14)
Stanciuc, N.; Cretu, A.A.; Banu, I.; Aprodu, I. Advances on the impact of thermal processing on structure and antigenicity of chicken ovomucoid. J. Sci. Food Agric. 2018, 98, 3119–3128. [PubMed]
(15)
Iannotti, L.L.; Lutter, C.K.; Bunn, D.A.; Stewart, C.P. Eggs: The uncracked potential for improving maternal and young child nutrition among the world’s poor. Nutr. Rev. 2014, 72, 355–368. [CrossRef] [PubMed]
(16)
Pachón, H.; Simondon, K.B.; Fall, S.T.; Menon, P.; Ruel, M.T.; Hotz, C.; Creed-Kanashiro, H.; Arce, B.; Domínguez, M.R.; Frongillo, E.A.; et al. Constraints on the delivery of animal source foods to infants and young children: Case studies from five countries. Food Nutr. Bull. 2007, 28, 215–229. [CrossRef]
(17)
Alive & Thrive. Infant and Young Child Feeding in Communities: A Rapid Assessment in Tigray and SNNPR, Ethiopia; Alive & Thrive: Addis Ababa, Ethiopia, 2010.
(18)
Jinadu, M.K.; Ojofeitimi, E.O.; Sifor, E.O. Feeding patterns of children with protein-energy malnutrition in Nigeria. Trop. Doct. 1986, 16, 82–85. [CrossRef]
(19)
Sullivan, J.; Ndekha, M.; Maker, D.; Hotz, C.; Manary, M.J. The quality of the diet in Malawian children with kwashiorkor and marasmus. Matern. Child Nutr. 2006, 2, 114–122. [CrossRef]
(20)
Lutter, C.K.; Iannotti, L.L.; Stewart, C.P. The potential of a simple egg to improve maternal nutrition. In Eggs: A Potential Food for Improving Maternal and Child Nutrition; Wiley: Hoboken, NJ, USA, 2018; Volume 14.
(21)
Cao, J.; Wei, X.; Tang, X.; Jiang, H.; Fan, Z.; Yu, Q.; Chen, J.; Liu, Y.; Li, T. Effects of egg and Vitamin A supplementation on hemoglobin, retinol status and physical growth of primary and middle school students in Chongqing, China. Asia Pac. J. Clin. Nutr. 2013, 22, 214–221.
(22)
Guldan, G.S.; Fan, H.C.; Ma, X.; Ni, Z.Z.; Xiang, X.; Tang, M.Z. Culturally appropriate nutrition education improves infant feeding and growth in rural Sichuan, China. J. Nutr. 2000, 130, 1204–1211. [CrossRef]
(23)
Ianannotti, L.L.; Lutter, C.K.; Stewart, C.P.; Gallegos Riofrio, C.A.; Malo, C.; Reignhar, G.; Walters, W.F. Eggs in early complementary feeding and child growth. A randomized controlled trial. Pediatrics 2017, 140, e20163459. [CrossRef]
(24)
Iananotti, L.; Cunningham, K.; Ruel, M.T. Diversifying into healthy diets: Homestead food production in Bangladesh. In Millions Fed: Proven Success in Agricultural Development; Spielman, D.J., Pandya-Lorch, R., Eds.; International Policy Research Institute: Washington, DC, USA, 2009; pp. 145–151.
(25)
Olney, D.K.; Talukder, A.; Iannotti, L.L.; Ruel, M.T.; Quinn, V. Assessing impact and impact pathways of a homestead food production program on household and child nutrition in Cambodia. Food Nutr. Bull. 2009, 30, 355–369. [CrossRef]
(26)
De Pee, S.; Bloem, M.W.; Satoto; Yip, R.; Sukaton, A.; Tjiong, R.; Shrimpton, R.; Muhilal Kodyat, B. Impact of a social marketing campaign promoting dark-green leafy vegetables and eggs in central Java, Indonesia. Int. J. Vitam. Res. 1998, 68, 389–398.
(27)
Nielsen, H.; Roos, N.; Thisted, S.H. The impact of semi-scavenging poultry production on the consumption of animal source foods by women and girls in Bangladesh. J. Nutr. 2003, 133, 4027S–4030S. [CrossRef] [PubMed]
(28)
Gala, O.M.; Harrison, G.G.; Abdou, A.I.; Zein el Abedin, A. The impact of a small scale agricultural intervention on socio-economic and health status. Food Nutr. 1987, 13, 35–43.
(29)
Hunter, G.R.; McCarthy, J.P.; Bamman, M.M. Effects of resistance training on older adults. Sports Med. 2004, 34, 329–348. [CrossRef] [PubMed]
(30)
Sillanpaa, E.; Laaksonen, D.E.; Hakkinen, A.; Karavirta, L.; Jensen, B.; Kraemer, W.J.; Nyman, K.; Hakkinen, K. Body composition, fitness, and metabolic health during strength and endurance training and their combination in middle-aged and older women. Eur. J. Appl. Physiol. 2009, 106, 285–296. [CrossRef] [PubMed]
(31)
Klimcakova, E.; Polak, J.; Moro, C.; Hejnova, J.; Majercik, M.; Viguerie, N.; Berlan, M.; Langin, D.; Stich, V. Dynamic strength training improves insulin sensitivity without altering plasma levels and gene expression of adipokines in subcutaneous adipose tissue in obese men. J. Clin. Endocrinol. Metab. 2006, 91, 5107–5112.
(32)
Kohrt, W.M.; Bloomfield, S.A.; Little, K.D.; Nelson, M.E.; Yingling, V.R. American College of Sports Medicine American Collegeof Sports Medicine Position Stand: Physical activity and bone health. Med. Sci. Sports Exerc. 2004, 36, 1985–1996. [CrossRef]
(33)
Collier, S.R.; Kanaley, J.A.; Carhart, R., Jr.; Frechette, V.; Tobin, M.M.; Bennett, N.; Luckenbaugh, A.N.; Fernhall, B. Cardiac autonomic function and baroreflex changes following 4 weeks of resistance versus aerobic training in individuals with prehypertension. Acta Physiol. 2009, 195, 339–348. [CrossRef]
(34)
Newman, A.B.; Kupelian, V.; Visser, M.; Simonsick, E.M.; Goodpaster, B.H.; Kritchevsky, S.B.; Tylavsky, F.A.; Rubin, S.M.; Harris, T.B. Strength, but not muscle mass, is associated with mortality in the health, aging and body composition study cohort. J. Gerontol. Ser. A Biol. Sci. Med. Sci. 2006, 61, 72–77. [CrossRef]
(35)
Phillips, S.M. Protein requirements and supplementation in strength sports. Nutrition 2004, 20, 689–695. [CrossRef] 36. Jäger, R.; Kerksick, C.M.; Campbell, B.I.; Cribb, P.J.; Wells, S.D.; Skwiat, T.M.; Purpura, M.; Ziegenfuss, T.N.; Ferrando, A.A.; Arent, S.M.; et al. International Society of Sports Nutrition Position Stand: Protein and exercise. J. Int. Soc. Sports Nutr. 2017, 14, 8. [CrossRef] [PubMed]
(37)
Antonio, J.; Ellerbroek, A.; Silver, T.; Orris, S.; Scheiner, M.; Gonzalez, A.; Peacock, C.A. A high protein diet (3.4 g/kg/d) combined with a heavy resistance training program improves body composition in healthy trained men and women—A follow-up investigation. J. Int. Soc. Sports Nutr. 2015, 12, 39. [CrossRef] [PubMed]
(38)
Antonio, J.; Ellerbroek, A.; Silver, T.; Vargas, L.; Tamayo, A.; Buehn, R.; Peacock, C.A. A High Protein Diet Has No Harmful Effects: A One-Year Crossover Study in Resistance-Trained Males. J. Nutr. Metab. 2016, 2016, 9104792. [CrossRef] [PubMed]
(39)
Fryar, C.D.; Carroll, M.D.; Afful, J. Prevalence of overweight, obesity, and severe obesity among adults aged 20 and over: United States, 1960–1962 through 2017–2018. NCHS Health E-Stats 2020. Available online: https://www.cdc.gov/nchs/data/hestat/ obesity-adult-17-18/overweight-obesity-adults-H.pdf (accessed on 11 June 2022).
(40)
U.S. Department of Agriculture USDA National Nutrient Database. Available online: https://ndb.nal.usda.gov/ndb/ (accessed on 14 June 2022).
(41)
Van Vliet, S.; Burd, N.A.; van Loon, L.J. The Skeletal Muscle Anabolic Response to Plant- versus Animal-Based Protein Consumption. J. Nutr. 2015, 145, 1981–1991. [CrossRef]
(42)
Food and Agriculture Organization. Report of a Sub-Committee of the 2011 FAO Consultation on “Protein Quality Evaluation in Human Nutrition”: The Assessment of Amino Acid Digestibility in Foods for Humans and including a Collation of Published Ileal Amino Acid Digestibility Data for Human Foods; WHO: Geneva, Switzerland, 2012.
(43)
Food and Agriculture Organization of the United Nations. United Nations University Protein and Amino Acid Requirements in Human Nutrition; WHO: Geneva, Switzerland, 2007.
(44)
Fouillet, H.; Juillet, B.; Gaudichon, C.; Mariotti, F.; Tome, D.; Bos, C. Absorption kinetics are a key factor regulating postprandial protein metabolism in response to qualitative and quantitative variations in protein intake. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2009, 297, R1691–R1705. [CrossRef]
(45)
Norton, L.E.; Wilson, G.J.; Moulton, C.J.; Layman, D.K. Meal Distribution of Dietary Protein and Leucine Influences Long-Term Muscle Mass and Body Composition in Adult Rats. J. Nutr. 2017, 147, 195–201.
(46)
Moore, D.R.; Robinson, M.J.; Fry, J.L.; Tang, J.E.; Glover, E.I.;Wilkinson, S.B.; Prior, T.; Tarnopolsky, M.A.; Phillips, S.M. Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am. J. Clin. Nutr. 2009, 89, 161–168. [CrossRef]
(47)
Witard, O.C.; Jackman, S.R.; Breen, L.; Smith, K.; Selby, A.; Tipton, K.D. Myofibrillar muscle protein synthesis rates subsequent to a meal in response to increasing doses of whey protein at rest and after resistance exercise. Am. J. Clin. Nutr. 2014, 99, 86–95.
(48)
Hida, A.; Hasegawa, Y.; Mekata, Y.; Usuda, M.; Masuda, Y.; Kawano, H.; Kawano, Y. Effects of egg white protein supplementation on muscle strength and serum free amino acid concentrations. Nutrients 2012, 4, 1504–1517. [CrossRef]
(49)
Iglay, H.B.; Apolzan, J.W.; Gerrard, D.E.; Eash, J.K.; Anderson, J.C.; Campbell, W.W. Moderately increased protein intake predominately from egg sources does not influence whole body, regional, or muscle composition responses to resistance training in older people. J. Nutr. Health Aging 2009, 13, 108–114.
(50)
Kato, Y.; Sawada, A.; Numao, S.; Suzuki, M. Chronic effect of light resistance exercise after ingestion of a high-protein snack on increase of skeletal muscle mass and strength in young adults. J. Nutr. Sci. Vitaminol. 2011, 57, 233–238. [CrossRef] [PubMed]
(51)
Bagheri, R.; Hooshmand Moghadam, B.; Ashtary-Larky, D.; Forbes, S.C.; Candow, D.G.; Galpin, A.J.; Eskandari, M.; Kreider, R.B.; Wong, A. Whole Egg Vs. Egg White Ingestion During 12 weeks of Resistance Training in Trained Young Males: A Randomized Controlled Trial. J. Strength Cond Res. 2021, 35, 411–419.
(52)
Bagheri, R.; Hooshmand Moghadam, B.; Jo, E.; Tinsley, G.M.; Stratton, M.T.; Ashtary-Larky, D.; Eskandari, M.; Wong, A. Comparison of whole egg v. egg white ingestion during 12 weeks of resistance training on skeletal muscle regulatory markers in resistance-trained men. Br. J. Nutr. 2020, 124, 1035–1043. [CrossRef] [PubMed]
(53)
Matsuoka, R.; Shirouchi, B.; Umegatani, M.; Fukuda, M.; Muto, A.; Masuda, Y.; Kunou, M.; Sato, M. Dietary egg-white protein increases body protein mass and reduces body fat mass through an acceleration of hepatic beta-oxidation in rats. Br. J. Nutr. 2017, 118, 423–430. [CrossRef] [PubMed]
(54)
Eckfeldt, G.A.; Sheffner, A.L.; Spector, H. The pepsin-digest-residue (PDR) amino acid index of net protein utilization. J. Nutr. 1956, 60, 105–120.
(55)
Matsuoka, R.; Shirouchi, B.; Kawamura, S.; Baba, S.; Shiratake, S.; Nagata, K.; Imaizumi, K.; Sato, M. Dietary egg white protein inhibits lymphatic lipid transport in thoracic lymph duct-cannulated rats. J. Agric. Food Chem. 2014, 62, 10694–10700. [CrossRef]
(56)
Gargouri, Y.; Julien, R.; Sugihara, A.; Verger, R.; Sarda, L. Inhibition of pancreatic and microbial lipases by proteins. Biochim. Biophys. Acta 1984, 795, 326–331. [CrossRef]
(57)
Van Loon, L.J. Leucine as a pharmaconutrient in health and disease. Curr. Opin. Clin. Nutr. Metab. Care 2012, 15, 71–77. [CrossRef]
(58)
Van Vliet, S.; Shy, E.L.; Abou Sawan, S.; Beals, J.W.;West, D.W.; Skinner, S.K.; Ulanov, A.V.; Li, Z.; Paluska, S.A.; Parsons, C.M.; et al. Consumption of whole eggs promotes greater stimulation of postexercise muscle protein synthesis than consumption of isonitrogenous amounts of egg whites in young men. Am. J. Clin. Nutr. 2017, 106, 1401–1412. [CrossRef]
(59)
Santos, H.O.; Gomes, G.K.; Schoenfeld, B.J.; de Oliveira, E.P. The Effect of Whole Egg Intake on Muscle Mass: Are the Yolk and Ist Nutrients Important? Int. J. Sport Nutr. Exerc. Metab. 2021, 31, 514–521. [CrossRef]
(60)
Evans, W.; Shankaran, M.; Nyangau, E.; Field, T.; Mohammed, H.; Wolfe, R.; Schutzler, S.; Hellerstein, M. Effects of Fortetropin on the Rate of Muscle Protein Synthesis in Older Men andWomen: A Randomized, Double-Blinded, Placebo-Controlled Study. J. Gerontol. Ser. A 2021, 76, 108–114. [CrossRef] [PubMed]
(61)
Fernandez, M.L. Rethinking dietary cholesterol. Curr. Opin. Med. Nutr. Metab. Care 2012, 15, 17–21. [CrossRef] [PubMed]
(62)
Pasiakos, S.M.; Cao, J.J.; Margolis, L.M.; Sauter, E.R.; Whigham, L.D.; McClung, J.P.; Rood, J.C.; Carbone, J.W.; Combs, G.F., Jr.; Young, A.J. Effects of high-protein diets on fat-free mass and muscle protein synthesis following weight loss: A randomized controlled trial. FASEB J. 2013, 27, 3837–3847. [CrossRef]
(63)
U.S. Department of Health and Human Services Physical Activity Guidelines for Americans. Available online: https://health. gov/sites/default/files/2019-09/Physical_Activity_Guidelines_2nd_edition.pdf (accessed on 18 June 2022).
(64)
Deutz, N.E.; Bauer, J.M.; Barazzoni, R.; Biolo, G.; Boirie, Y.; Bosy-Westphal, A.; Cederholm, T.; Cruz-Jentoft, A.; Krznariç, Z.; Nair, K.S.; et al. Protein intake and exercise for optimal muscle function with aging: Recommendations from the ESPEN Expert Group. Clin. Nutr. 2014, 33, 929–936. [CrossRef] [PubMed]
(65)
Smith, A.; Gray, J. Considering the benefits of egg consumption for older people at risk of sarcopenia. Br. J. Community Nurs. 2016, 21, 305–309. [CrossRef]
(66)
Paddon-Jones, D.; Campbell, W.W.; Jacques, P.F.; Kritchevsky, S.B.; Moore, L.L.; Rodriguez, N.R.; van Loon, L.J. Protein and healthy aging. Am. J. Clin. Nutr. 2015, 101, 1339S–1345S. [CrossRef]
(67)
Murton, A.J. Muscle protein turnover in the elderly and its potential contribution to the development of sarcopenia. Proc. Nutr. Soc. 2015, 74, 387–396. [CrossRef]
(68)
Christensen, K.; Doblhammer, G.; Rau, R.; Vaupel, J.W. Ageing populations: The challenges ahead. Lancet 2009, 374, 1196–1208. [CrossRef]
(69)
Johnston, A.P.; De Lisio, M.; Parise, G. Resistance training, sarcopenia, and the mitochondrial theory of aging. Appl. Physiol. Nutr. Metab. 2008, 33, 191–199. [CrossRef]
(70)
Wall, B.T.; van Loon, L.J. Nutritional strategies to attenuate muscle disuse atrophy. Nutr. Rev. 2013, 71, 195–208. [CrossRef]
(71)
Boirie, Y. Fighting sarcopenia in older frail subjects: Protein fuel for strength, exercise for mass. J. Am. Med. Dir. Assoc. 2013, 14, 140–143. [CrossRef] [PubMed]
(72)
Bauer, J.; Biolo, G.; Cederholm, T.; Cesari, M.; Cruz-Jentoft, A.J.; Morley, J.E.; Phillips, S.; Sieber, C.; Stehle, P.; Teta, D.; et al. Evidence-based recommendations for optimal dietary protein intake in older people: A position paper from the PROT-AGE Study Group. J. Am. Med. Dir. Assoc. 2013, 14, 542–559. [CrossRef] [PubMed]
(73)
Fulgoni, V.L. 3rd Current protein intake in America: Analysis of the National Health and Nutrition Examination Survey, 2003–2004. Am. J. Clin. Nutr. 2008, 87, 1554S–1557S. [CrossRef] [PubMed]
(74)
Mendonca, N.; Hill, T.R.; Granic, A.; Davies, K.; Collerton, J.; Mathers, J.C.; Siervo, M.; Wrieden, W.L.; Seal, C.J.; Kirkwood, T.B.; et al. Macronutrient intake and food sources in the very old: Analysis of the Newcastle 85+ Study. Br. J. Nutr. 2016, 115, 2170–2180. [PubMed]
(75)
Tieland, M.; Borgonjen-Van den Berg, K.J.; van Loon, L.J.; de Groot, L.C. Dietary protein intake in community-dwelling, frail, and institutionalized elderly people: Scope for improvement. Eur. J. Nutr. 2012, 51, 173–179. [CrossRef] [PubMed]
(76)
Asp, M.L.; Richardson, J.R.; Collene, A.L.; Droll, K.R.; Belury, M.A. Dietary protein and beef consumption predict for markers of muscle mass and nutrition status in older adults. J. Nutr. Health Aging 2012, 16, 784–790. [CrossRef]
(77)
Pennings, B.; Groen, B.B.; van Dijk, J.W.; de Lange, A.; Kiskini, A.; Kuklinski, M.; Senden, J.M.; van Loon, L.J. Minced beef is more rapidly digested and absorbed than beef steak, resulting in greater postprandial protein retention in older men. Am. J. Clin. Nutr. 2013, 98, 121–128. [CrossRef]
(78)
Robinson, M.J.; Burd, N.A.; Breen, L.; Rerecich, T.; Yang, Y.; Hector, A.J.; Baker, S.K.; Phillips, S.M. Dose-dependent responses of myofibrillar protein synthesis with beef ingestion are enhanced with resistance exercise in middle-aged men. Appl. Physiol. Nutr. Metab. 2013, 38, 120–125. [CrossRef]
(79)
Pannemans, D.L.; Wagenmakers, A.J.; Westerterp, K.R.; Schaafsma, G.; Halliday, D. Effect of protein source and quantity on protein metabolism in elderly women. Am. J. Clin. Nutr. 1998, 68, 1228–1235. [CrossRef]
(80)
Kim, I.Y.; Shin, Y.A.; Schutzler, S.E.; Azhar, G.; Wolfe, R.R.; Ferrando, A.A. Quality of meal protein determines anabolic response in older adults. Clin. Nutr. 2018, 37, 2076–2083. [CrossRef]
(81)
Bosaeus, I.; Rothenberg, E. Nutrition and physical activity for the prevention and treatment of age-related sarcopenia. Proc. Nutr. Soc. 2016, 75, 174–180. [CrossRef] [PubMed]
(82)
Guillet, C.; Masgrau, A.;Walrand, S.; Boirie, Y. Impaired protein metabolism: Interlinks between obesity, insulin resistance and inflammation. Obes. Rev. 2012, 13 (Suppl. 2), 51–57. [CrossRef] [PubMed]
(83)
Wright, C.S.; Zhou, J.; Sayer, R.D.; Kim, J.E.; Campbell, W.W. Effects of a High-Protein Diet Including Whole Eggs on Muscle Composition and Indices of Cardiometabolic Health and Systemic Inflammation in Older Adults with Overweight or Obesity: A Randomized Controlled Trial. Nutrients 2018, 10, 946. [CrossRef] [PubMed]
(84)
Ullevig, S.L.; Zuniga, K.; Austin Lobitz, C.; Santoyo, A.; Yin, Z. Egg protein supplementation improved upper body muscle strength and protein intake in community-dwelling older adult females who attended congregate meal sites or adult learning centers: A pilot randomized controlled trial. Nutr. Health 2021, 3, 02601060211051592.
(85)
Kido, K.; Koshinaka, K.; Iizawa, H.; Honda, H.; Hirota, A.; Nakamura, T.; Arikawa, M.; Ra, S.G.; Kawanaka, K. Egg White Protein Promotes Developmental Growth in Rodent Muscle Independently of Leucine Content. J. Nutr. 2022, 152, 117–129. [CrossRef]
(86)
Riddle, E.S.; Stipanuk, M.H.; Thalacker-Mercer, A.E. Amino acids in healthy aging skeletal muscle. Front. Biosci. 2016, 8, 326–350.
(87)
Jiayu, Y.; Botta, A.; Simtchouk, S.; Winkler, J.; Renaud, L.M.; Dadlani, H.; Rasmussen, B.; Elango, R.; Ghosh, S. Egg white consumption increases GSH and lowers oxidative damage in 110-week-old geriatric mice hearts. J. Nutr. Biochem. 2020, 76, 108252. [CrossRef]
(88)
Chucri, T.M.; Monteriro, J.M.; Lima, A.R.; Salvador, M.L.B.; Kfoury Junior, J.R.; Miglino, M.A. A review of immune transfer by the placenta. J. Reprod. Immunol. 2010, 87, 14–20. [CrossRef]
(89)
Kovas-Nolan, J.; Mine, Y. Egg yolk antibodies for passive immunity. Annu. Rev. Food Sci. Technol. 2012, 3, 163–182. [CrossRef]
(90)
Li, X.; Yao, Y.; Wang, X.; Zhen, Y.; Thacker, P.A.; Wang, L.; Shi, M.; Zhao, J.; Zong, Y.; Wang, N.; et al. Chicken egg yolk antibodies (IgY) modulate the intestinal mucosal immune response in a mouse model of Salmonella typhimurium infection. Int. Immunopharmacol. 2016, 36, 305–314. [CrossRef]
(91)
Ibrahim, H.R.; Aoki, T.; Pellegrini, A. Strategies for new antimicrobial proteins and peptides: Lysozyme and aprotinin as model molecules. Curr. Pharmaceut. Des. 2002, 8, 671–693. [CrossRef] [PubMed]
(92)
Banks, J.G.; Board, R.G.; Sparks, N.H. Natural antimicrobial systems and their potential in food preservation of the future. Biotech. Appl. Biochem. 1986, 8, 103–147.
(93)
Brady, D.; Gaines, S.; Fenelon, J. A Lipoprotein-derived Antimicrobial Factor from Hen-egg Yolk is Active against Streptococcus Species. J. Food Sci. 2002, 67, 3096–3103.
(94)
Wu, J.P.; Acero-Lopez, A. Ovotransferrin: Structure, bioactivities, and preparation. Food Res. Int. 2012, 46, 480–487. [CrossRef]
(95)
Fujita, H.; Sasaki, R.; Yoshikawa, M. Potentiation of the antihypertensive activity of orally administered ovokinin, a vasorelaxing peptide derived from ovalbumin, by emulsification in egg phosphatidylcholine. Biosci. Biotech. Biochem. 1995, 59, 2344–2345.
(96)
Jahandideh, F.; Majumder, K.; Chakrabarti, S.; Morton, J.S.; Panahi, S.; Kaufman, S.; Davidge, S.T.; Wu, J. Beneficial effects of simulated gastro-intestinal digests of fried egg and its fractions on blood pressure, plasma lipids and oxidative stress in spontaneously hypertensive rats. PLoS ONE 2014, 9, e115006.
(97)
Lee, M.; Kovacs-Nolan, J.; Yang, C.; Archbold, T.; Fan, M.Z.; Mine, Y. Hen egg lysozyme attenuates inflammation and modulates local gene expression in a porcine model of dextran sodium sulfate (DSS)-induced colitis. J. Agric. Food Chem. 2009, 57, 2233–2240.
(98)
Si, R.; Qu, K.; Jiang, Z.; Yang, X.; Gao, P. Egg consumption and breast cancer risk: A meta-analysis. Breast Cancer 2014, 21, 251–261.
(99)
Wu, J.; Zeng, R.; Huang, J.; Li, X.; Zhang, J.; Ho, J.C.; Zheng, Y. Dietary Protein Sources and Incidence of Breast Cancer: A Dose-Response Meta-Analysis of Prospective Studies. Nutrients 2016, 8, 730. [CrossRef]
(100)
Xie, B.; He, H. No association between egg intake and prostate cancer risk: A meta-analysis. Asian Pac. J. Cancer Prev. 2012, 13, 4677–4681. [CrossRef]
(101)
Das, S.; Banerjee, S.; Gupta, J.D. Experimental evaluation of preventive and therapeutic potentials of lysozyme. Chemotherapy 1992, 38, 350–357. [CrossRef] [PubMed]
(102)
Sava, G.; Benetti, A.; Ceschia, V.; Pacor, S. Lysozyme and cancer: Role of exogenous lysozyme as anticancer agent (review). Anticancer Res. 1989, 9, 583–591. [PubMed]
(103)
Hap, A.; Kielan,W.; Grzebieniak, Z.; Siewinski, M.; Rudnicki, J.; Tarnawa, R.; Rudno-Rudzinska, J.; Agrawal, A.K. Control of active B and L cathepsins in tissues of colorectal cancer using cystatins isolated from chicken egg proteins: In vitro studies. Folia Histochem. Cytobiol. 2011, 49, 670–676. [CrossRef] [PubMed]
(104)
Ishikawa, S.; Asano, T.; Takenoshita, S.; Nozawa, Y.; Arihara, K.; Itoh, M. Egg yolk proteins suppress azoxymethane-induced aberrant crypt foci formation and cell proliferation in the colon of rats. Nutr. Res. 2009, 29, 64–69. [CrossRef] [PubMed]
(105)
Wang, Y.; Beydoun, M.A.; Liang, L.; Caballero, B.; Kumanyika, S.K. Will all Americans become overweight or obese? Estimating the progression and cost of the US obesity epidemic. Obesity 2008, 16, 2323–2330. [CrossRef]
(106)
Holt, S.H.; Miller, J.C.; Petocz, P.; Farmakalidis, E. A satiety index of common foods. Eur. J. Clin. Nutr. 1995, 49, 675–690.
(107)
Cummings, D.E.; Purnell, J.Q.; Frayo, R.S.; Schmidova, K.;Wisse, B.E.;Weigle, D.S. A preprandial rise in plasma ghrelin levels suggests a role in meal initiation in humans. Diabetes 2001, 50, 1714–1719. [CrossRef]
(108)
Ratliff, J.; Leite, J.O.; de Ogburn, R.; Puglisi, M.J.; VanHeest, J.; Fernandez, M.L. Consuming eggs for breakfast influences plasma glucose and ghrelin, while reducing energy intake during the next 24 hours in adult men. Nutr. Res. 2010, 30, 96–103. [CrossRef]
(109)
Missimer, A.; DiMarco, D.M.; Andersen, C.J.; Murillo, A.G.; Fernandez, M.L. Consuming 2 eggs per day, as compared to an oatmeal breakfast, decreases plasma ghrelin and maintains the LDL/HDL ratio. Nutrients 2017, 9, 89. [CrossRef]
(110)
Foster-Schubert, K.E.; Overduin, J.; Prudom, C.E.; Liu, J.; Callahan, H.S.; Gaylinn, B.D.; Thorner, M.O.; Cummings, D.E. Acyl and total ghrelin are suppressed strongly by ingested proteins, weakly by lipids, and biphasically by carbohydrates. J. Clin. Endocrinol. Metab. 2008, 93, 1971–1979. [CrossRef]
(111)
Vander Wal, J.S.; Marth, J.M.; Khosla, P.; Jen, K.L.; Dhurandhar, N.V. Short-term effect of eggs on satiety in overweight and obese subjects. J. Am. Coll. Nutr. 2005, 24, 510–515. [CrossRef] [PubMed]
(112)
Vander Wal, J.S.; Gupta, A.; Khosla, P.; Dhurandhar, N.V. Egg breakfast enhances weight loss. Int. J. Obes. 2008, 32, 1545–1551.
(113)
Rueda, J.M.; Khosla, P. Impact of breakfasts (with or without Eggs) on body weight regulation and blood lipids in university students over a 14-week semester. Nutrients 2013, 5, 5097–5113. [CrossRef] [PubMed]
(114)
https://www.frontiersin.org/articles/10.3389/fspor.2022.950949/full
(115)
https://academic.oup.com/advances/article/13/4/1083/6433619
(116)
https://pubmed.ncbi.nlm.nih.gov/35538903/
(117)
https://jissn.biomedcentral.com/articles/10.1186/s12970-017-0177-8
(118)
https://pubmed.ncbi.nlm.nih.gov/35945651/
(119)
https://www.clinicalnutritionjournal.com/article/S0261-5614(22)00323-5/fulltext
(120)
Bildquellen:
Creative Commons — Namensnennung-Weitergabe unter gleichen Bedingungen 3.0 Unportiert — CC BY-SA 3.0