HISTIDIN – Eine essenzielle Aminosäure? Vor einigen Jahren haben EAA (essenzielle Aminosäuren) BCAA (verzweigtkettige Aminosäuren) auf dem großen Markt der Aminosäure-Ergänzungen ersetzt. Das wie und warum wurde im BLOG von Body-Coaches bereits vor mehreren Jahren erörtert. Fest steht, für die allermeisten Nutzer von Aminosäure-Präparten es ist richtig so!
Der Aufbau einer optimalen Ergänzung auf Basis von essenziellen Aminosäuren ist nicht klar definiert, weshalb die Supplement-Industrie dies „Freestyle“ behandelt, nach dem Motto „jeder wie er will“. Großer Verkaufs-Trick ist es, mehr BCAA als die Konkurrenz in die EAA-Mischung zu geben, oder aber EAA-Pulver mit geschmacklich aufwertenden Zusätzen zu versehen, da ein höherer Anteil schwefelhaltiger Aminosäuren wie beispielsweise Methionin in EAA das Aroma beeinflusst und sogar üblen Mundgeruch erzeugen kann, wenn man es damit übertreibt. Beide Tricks sind für das priorisierte Ziel eines möglichst effektiven Aminosäure-Produkts schwachsinnig, dies muss hierzu erwähnt werden.
Während man sich bei acht essenziellen Aminosäuren einig ist, dass diese in einer EAA-Ergänzung vorzufinden sein müssen, herrscht ein „Wissenskampf“ über die Verwendung der Aminosäure Histidin. Besonders auf YouTube oder in anderen sozialen Medien finden sich Aminosäure-Spezialisten, die in mühsam aufgearbeiteten Reviews mehrere EAA-Produkte vergleichen und diejenigen schlecht reden, denen es an Histidin mangelt. Screenshots der aktuellen WHO-Vorgabe oder aus dem Kontext gerissene Auszüge einzelner Studien sollen es richten und neben den Abo-Zahlen auch die Glaubwürdigkeit sichern.
Ich denke es wird Zeit, das Thema Histidin und seinen Stellenwert als essenzielle Aminosäure einmal von Grund auf zu erörtern.
Was ist „Essenziell“
Die Einteilung in essenzielle und nicht essenzielle Aminosäuren wurde erstmals in Ernährungsstudien Anfang des 19. Jahrhunderts vorgenommen. In einer Studie (5) wurde festgestellt, dass der menschliche Körper in der Lage ist, sein Stickstoffgleichgewicht mit einer Ernährung dieser acht Aminosäuren aufrechtzuerhalten.
Dies war die erste Klassifizierung von essenziellen oder unverzichtbaren Aminosäuren. Zu dieser Zeit konnten die Wissenschaftler essenzielle Aminosäuren durch Fütterungsstudien mit gereinigten Aminosäuren identifizieren. Die Forscher fanden heraus, dass die Versuchspersonen nicht mehr wachsen oder ihr Stickstoffgleichgewicht nicht mehr halten konnten, wenn einzelne essenzielle Aminosäuren aus der Nahrung entfernt wurden.
Stand heute definiert man essenzielle Aminosäuren (oder unentbehrliche Aminosäuren) als solche, die der Mensch nicht aus Stoffwechselzwischenprodukten synthetisieren kann. Sie müssen mit der Nahrung zugeführt werden, da dem menschlichen Körper die für die Synthese erforderlichen Stoffwechselwege fehlen (1,2).
Histidin essenziell? – Das sagen Studien
Zunächst einmal ist interessant zu wissen, dass es sich bei Histidin neben 21 anderen Aminosäuren um eine sogenannte proteinbildende Aminosäure handelt (3). Eine Tatsache die einen grundlegenden Stellenwert für Proteinaufbau bezeugt. Im Verlauf der vergangenen Jahre und Jahrzehnte wurden einige Studien durchgeführt, die sich mit der Frage befassten, ob für Histidin nach oben genannter Definition ein essenzieller Bedarf besteht. Einige dieser Studien sind hier in Kürze vorgestellt:
- Rose et al (12) positionierten sich bereits 1954 in dem sie Histidin als nicht essenzielle Aminosäure zur Aufrechterhaltung des Stickstoffgleichgewichts im Körper herausstellen (12).
- Stifel & Herman (14) bestätigen 1972 Rose et al weitestgehend und zitieren weitere Studien, die Histidin eine Rolle zur Aufrechterhaltung des Stickstoffgleichgewichts beim Erwachsenen absprechen. Als Säugling sei man jedoch auf Histidin mit einem essenziellen Bedarf angewiesen.
- Studien (16-18), die mit der ausschließlichen Verabreichung des sogenannten Master Amino Pattern als Aminosäure-Quelle durchgeführt wurden, berichten von einer stabilen Stickstoffbilanz. Die Untersuchungen wurden an Übergewichtigen (n=114) oder Athleten/innen (n=21) und über Versuchszeiträume von 3 bis 4 Wochen durchgeführt. Die MAP-Formel ist dafür bekannt, kein Histidin zu enthalten.
- Cho et al (6) verabreichten 7 jungen Männern über 8 Wochen eine sehr Stickstoff arme (6,3g/Tag) sowie gleichzeitig Histidin arme (10mg/Tag) Diät. In diesem künstlich so herbeigeführten Zustand stellten sie fest, dass die Rate der endogenen Versorgung mit Histidin bei länger andauernder Mangelernährung nicht ausreichend zu sein scheint. Sie empfehlen darauf basierend, Histidin als essenzielle Aminosäure anzusehen. Einen ähnlich aufgebauten Versuch an 4 gesunden und 3 chronisch urämischen Probanden mit einer Low-Protein-Diet führten Kopple et al durch (15).

- Lopez & Mohiuddin (4) beschreiben Histidin einerseits als essenziell, andererseits führen sie an, dass es sich bei Histidin und auch Arginin um bedingt essenzielle Aminosäuren handelt, deren Bedarf in bestimmten Phasen wie einer Schwangerschaft, in der Pubertät oder nach einem Trauma nicht in ausreichender Menge synthetisiert werden kann.
- Tamaki et al (8) stellen im Tiermodell fest, dass Histidin bedingt aus Carnosin rückgewonnen werden kann. Hinweise hierauf finden sich auch in einer Studie von Kriengsinyos et al (21) die binnen 48 Tage Histidin freier Diät keine Beeinträchtigung des Stickstoffgleichgewichts feststellte. Die Forscher vermuteten Histidin kompensierende Effekte ausgehend von Carnosin-Speichern (22,23).
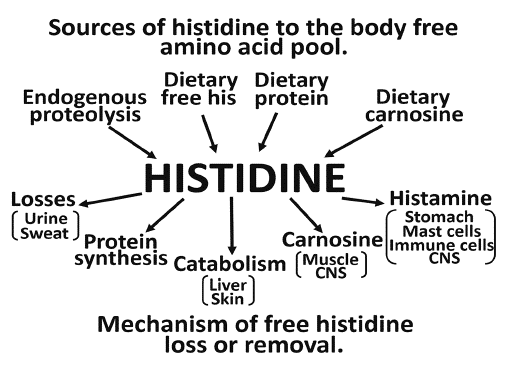
Alle Wege die Histidin im Körper gehen kann beschreiben Brosnan & Brosnan (10).
Histidin essenziell? – Das sagen Empfehlungen
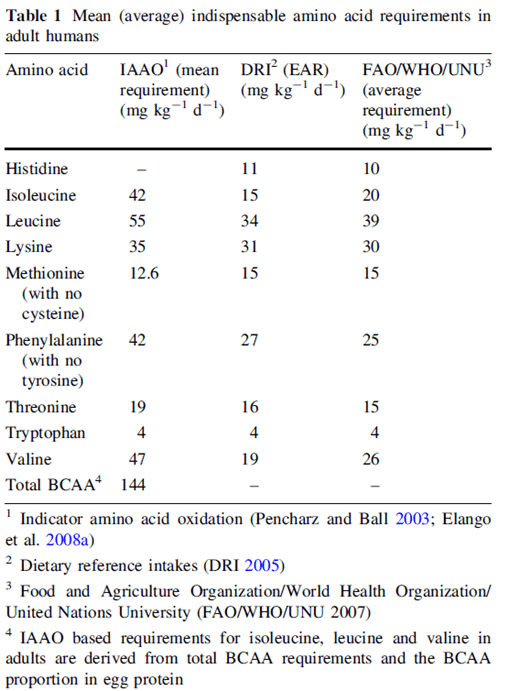
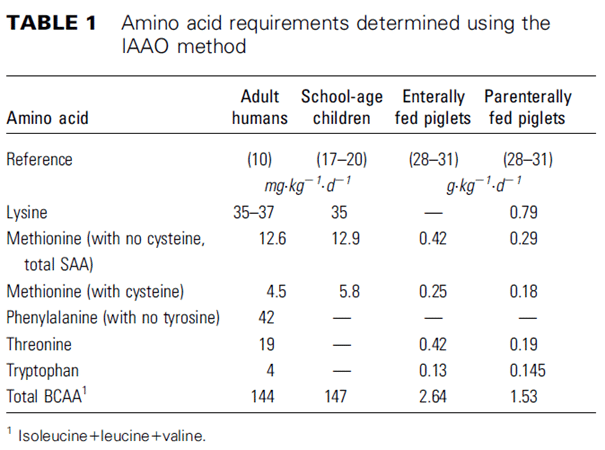
Elango et al (19) fassen 2009 mehrere Empfehlungen zum Bedarf an unverzichtbaren Aminosäuren bei Erwachsenen zusammen. Im Folgenden werden alle drei Angaben in Bezug auf Histidin genauer vorgestellt.
IAAO-Methode
Bayley et al entwickelten die IAAO-Methode um den Aminosäurebedarf von jungen Schweinen im Wachstum zu ermitteln. Das Konzept wurde auf den Menschen übertragen. Die Technik der Indikator-Aminosäure-Oxidation (IAAO) basiert auf der Annahme, dass bei einem Mangel an einer unentbehrlichen Aminosäure für die Proteinsynthese alle anderen Aminosäuren oxidiert werden. Dies liegt grundlegend daran, dass Aminosäuren nicht gespeichert werden und daher entweder erfolgreich eingebaut oder oxidiert werden.
Elango et al (20) untersuchten basierend auf dieser Methodik den Aminosäure-Bedarf des erwachsenen Menschen, stellten diesen aber nicht für Histidin fest. Untermauernd wird hierzu eine Studie von Kriengsinyos et al (21) angeführt, in der 48 Tage mit Histidin freier Diät auf Basis einer Aminosäureversorgung, die der Verabreichung von 1g Protein pro Kilogramm Körpergewicht entspricht, zu keiner negativen Beeinträchtigung des Stickstoffgleichgewichts nach IAAO-Methode führte.
DRI – Dietary Reference Intake
Unter Dietary Reference Intakes (DRIs) versteht man eine Reihe von Referenzwerten, die zur Planung und Bewertung der Nährstoffzufuhr gesunder Menschen verwendet werden können. Für Histidin wird nach DRI (24) ein essenzieller Bedarf von 11mg/kg/kg und Tag für Erwachsene und von 18mg/kg/kg und Tag für Kinder von 1 bis 3 Jahren berechnet. Der RDA für Histidin liegt bei 14mg/kg/kg und Tag.
Der Unterschied, der für Histidin im Vergleich zu anderen Aminosäuren in Hinblick auf einen essenziellen Stellenwert gilt, findet sich in der Beschreibung der dem Beurteilungs-Paper beigefügten Tabelle:

„Obwohl Histidin als unentbehrlich gilt, erfüllt es im Gegensatz zu den anderen acht unentbehrlichen Aminosäuren nicht die zugrunde gelegten Kriterien der Verringerung der Eiweißablagerung und der unverzüglichen Herbeiführung einer negativen Stickstoffbilanz nach Entfernung aus der Nahrung“
Weiter heißt es:
„Nach Rose et al (28) führt der Entzug von Histidin in den ersten 10 Tagen nicht zu einer negativen Stickstoffbilanz. Männliche Probanden denen Aminosäuren mit 10g Stickstoff-Äquivalent ohne Histidin verabreicht wurden, blieben bis zu 2,4 Monate im Stickstoffgleichgewicht (29).“
WHO (World Health Organization)
Die am häufigsten zitierte Quelle beim Thema Histidin ist die WHO.
1.
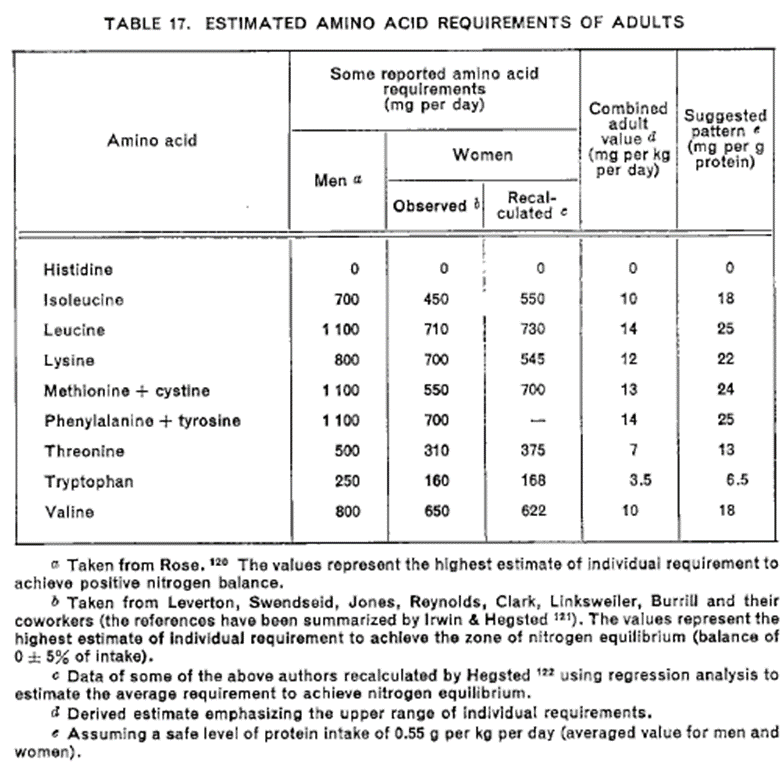
Im WHO-Report aus 1973 (25) wird Histidin noch zweifelsfrei als nicht essenzielle Aminosäure für Erwachsene angesehen.

2.
Im WHO-Statement (26) von 1985 kann man zu Histidin nachlesen:
„Histidin wird zunehmend als eine (teilweise) essenzielle Aminosäure bei Erwachsenen anerkannt, wobei der durchschnittliche Bedarf schätzungsweise die Hälfte, bis ein Drittel des Bedarfs von Säuglingen beträgt.“
3.
Das aktuelle WHO-Statement (27) berichtet von Histidin als essenzielle Aminosäure und dennoch von einer bestehenden Kontroverse.
Die Kontroverse zum essenziellen Stellenwert von Histidin lässt sich mitunter über den Faktor Zeit ableiten:
- Kurzzeitstudien (6-8 Tage) stellen keinen Histidin-Bedarf für den Erhalt eines Stickstoffgleichgewichts fest (32,33)
- Längerfristige Studien bis sogar 56 Tage Dauer sind bezüglich eines Histidin-Bedarfs zum Erhalt eines Stickstoffgleichgewichts uneinig (6,15,34)
Was ist anders bei Histidin?
Wie bereits weiter oben angeschnitten, verfügt Histidin anders als alle anderen 8 Aminosäuren über einen gewissen Pool, der einer Verarmung bei ungenügender Zufuhr über die Nahrung entgegenwirkt und eine negative Beeinflussung der Gesamtproteinbilanz vorbeugt.
- So weiß man bei Histidin-Restriktion von einer Reduzierung des Histidin-Pools aus Carnosin (30). Die vorhandenen Carnosin-Speicher im Körper eines Erwachsenen reichen für gewöhnlich aus, um Histidin freie oder Histidin arme Diäten zu kompensieren. Ausnahme bilden hier Säuglinge, da sie nur über eine begrenzte Menge eines hierzu notwendigen Enzyms verfügen (36,37).
- Mangelhafte Histidin-Aufnahme wirkt sich zudem auf die Hämoglobinkonzentration aus. Wird eine Histidin arme Diät über längere Zeit verfolgt, führt dies zu einem Abbau von Hämoglobin sowie einem Anstieg von Serumeisen (15,31,35).
- Letztlich werden weitere Kompensationsmöglichkeiten Histamin armer Ernährung diskutiert. Hierzu zählen Anpassungsreaktion wie eine verringerte Histamin-Oxidation (38-40) oder ein Rückgang des Ganzkörperproteinumsatzes (36).
Die WHO schreibt in deren aktueller Stellungnahme zu Histidin:
„Bis heute ist die Unverzichtbarkeit von Histidin bei gesunden Erwachsenen noch nicht geklärt.“
Trotz der bestehenden Kontroversen reiht die WHO, Histidin in die Riege essenzieller Aminosäuren ein und gibt den notwendigen Bedarf wie folgt vor:
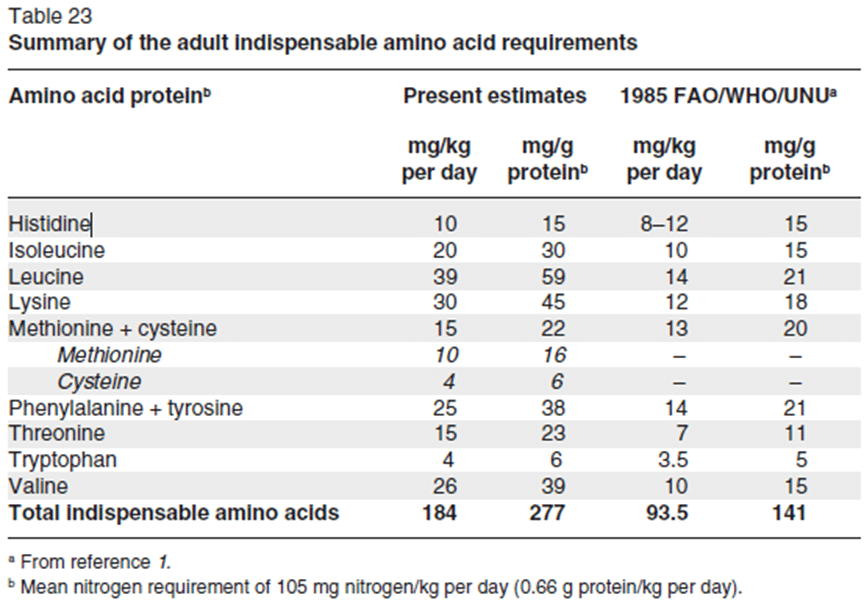
Wie viel Histidin brauche ich?
Wie bereits ausgeführt, bestehenden unterschiedliche Empfehlungen für die tägliche Aufnahme von Histidin bei Erwachsenen:
- DRI 11mg/kg/kg/Tag
- RDA 14mg/kg/kg/Tag
- WHO 10mg/kg/kg/Tag
Bezogen auf den WHO-Bedarf würde dies für eine 70kg schwere Person einen Histidin-Bedarf von 700mg täglich bedeuten.
Dies bringt uns zur Frage der tatsächlichen Relevanz des essenziellen Charakters für eine gewöhnliche Person. Schmidt et al (41) werteten hierzu die Histidin-Aufnahme einer 65.000 Probanden starken Kohorte aus dem vereinigten Königreich (UK) aus und stellten diese durchschnittlichen Aufnahmemengen fest:
Fleischesser 15% Proteinaufnahme Gesamtenergie 2120mg Histidin
Fischesser 13,6% Proteinaufnahme Gesamtenergie 1830mg Histidin
Vegetarier 13,3% Proteinaufnahme Gesamtenergie 1720mg Histidin
Veganer 12,6% Proteinaufnahme Gesamtenergie 1520mg Histidin
Auch für Deutschland gibt es eine spezifische Datenerhebung von Dietrich et al (42) mit immerhin 36 Veganern und 36 Omnivoren deren Histidin-Aufnahme mit durchschnittlich 20mg/kg/kg und Tag bei Veganern und 32mg/kg/kg und Tag bei Omnivoren ausgewertet wurde.
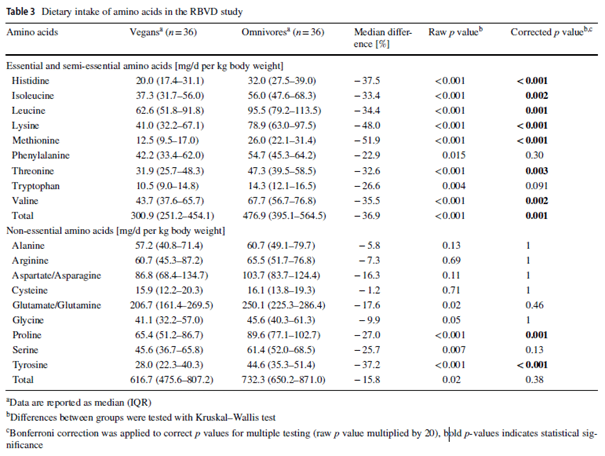
Datenerhebungen (24) aus den USA (NHANES III) geben einen durchschnittlichen Wert für die Histidin-Aufnahme aus Lebensmitteln und Nahrungsergänzungen aller Lebensabschnitte und Geschlechter von durchschnittlich 2,2g pro Tag an.
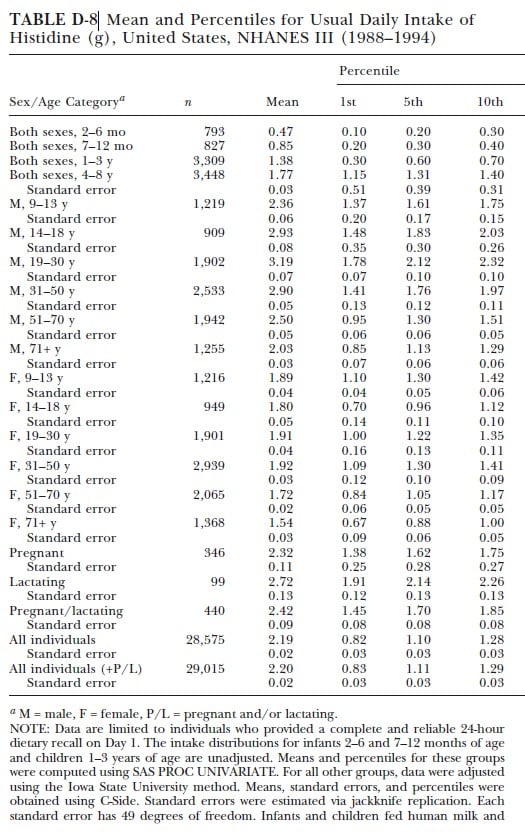
Der gewöhnliche Verzehr unterschiedlicher Diäten deckt den nach WHO definierten Histidin-Bedarf mit Leichtigkeit.
Histidin essenziell? – Das große Fazit
Aus allen involvierten Datenerhebung geht hervor:
- dass man sich bis heute nicht klar darüber ist, ob Histidin tatsächlich essenziell für den Erwachsenen ist oder nicht
- dass „essenziell“ bei Histidin etwas anderes bedeutet als bei den anderen acht unentbehrlichen Aminosäuren
- dass das „Fehlen“ von Histidin in einem EAA-Präparat keinen Einfluss auf die akute Reaktion des Proteinstoffwechsels haben wird und das Proteinaufbau auch ohne Histidin in einem EAA- Präparat uneingeschränkt von Statten geht
- dass selbst ein kurz- bis mittelfristiger kompletter Verzicht auf Histidin keine Auswirkung auf das körpereigene Stickstoffgleichgewicht haben wird, da wir über einen Histidin-Pool verfügen
- dass sich in der normalen Kost eines gesundheitlich engagierten Menschen mit einem relevanten Anteil an Protein ausreichend Histidin befindet, um den angenommenen essenziellen Bedarf zu decken
Sollte ich also Histidin als Teil meiner normalen Ernährung zuführen?
JA, das gilt allerdings nicht nur für Histidin, sondern auch für alle andere essenziellen Aminosäuren ebenso wie für nicht-essenzielle Aminosäuren. Im Regelfall muss man sich jedoch nicht gesondert darum bemühen, solange man ausreichend Gesamtprotein zuführt.
Da diese Diskussion mit dem Einsatz von EAA-Präparaten begonnen hat, soll sie auch damit enden. Histidin ist mittel- bis langfristig für den Erwachsenen wahrscheinlich essenziell was bedeutet, dass wir einen gewissen kleinen exogenen Bedarf haben, der sich jedoch gänzlich anders verhält als der Bedarf aller anderen unentbehrlichen Aminosäuren. Fehlendes Histidin in einer EAA-Matrix ist anders als von vielen Spezialisten behauptet kein Qualitäts-Kriterium. Die Tatsache, dass die WHO oder eine andere Institution Histidin einen essenziellen Charakter zugesprochen hat zu benutzen, um eine solche These aufzustellen zeugt wieder einmal davon, dass es insgesamt weniger Menschen geben sollte, die meinen, anderen etwas vermitteln zu müssen.
Für meine Community ist es mir wichtig, gerade beim Thema Aminosäuren immer die bestmöglichen Informationen bereit zu stellen. Aus diesem Grund dieser Beitrag!
Seid wachsam und bleibt kritisch!
Sportlicher Gruß
Holger Gugg
Quellen
(1)
https://pubmed.ncbi.nlm.nih.gov/26041391/
(2)
https://pubmed.ncbi.nlm.nih.gov/30239556/
(3)
https://pubmed.ncbi.nlm.nih.gov/8837875/
(4)
https://www.ncbi.nlm.nih.gov/books/NBK557845/
(5)
https://pubmed.ncbi.nlm.nih.gov/13465065/
(6)
https://pubmed.ncbi.nlm.nih.gov/6693997/
(7)
https://aocs.onlinelibrary.wiley.com/doi/abs/10.1002/aocs.12196
(8)
https://pubmed.ncbi.nlm.nih.gov/6533273/
(9)
https://pubmed.ncbi.nlm.nih.gov/31187867/
(10)
https://academic.oup.com/jn/article/150/Supplement_1/2570S/5913284
(11)
https://apps.who.int/iris/handle/10665/43411
(12)
https://pubmed.ncbi.nlm.nih.gov/13130563/
(13)
https://academic.oup.com/ajcn/article/85/5/1185/4633007
(14)
https://academic.oup.com/ajcn/article-abstract/25/2/182/4733211
(15)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC301830/
(16)
https://pubmed.ncbi.nlm.nih.gov/14964348/
(17)
https://pubmed.ncbi.nlm.nih.gov/14669816/
(18)
https://pubmed.ncbi.nlm.nih.gov/14669815/
(19)
https://link.springer.com/article/10.1007/s00726-009-0234-y
(20)
https://pubmed.ncbi.nlm.nih.gov/18203885/
(21)
https://pubmed.ncbi.nlm.nih.gov/12421848/
(22)
https://pubmed.ncbi.nlm.nih.gov/10539772/
(23)
https://pubmed.ncbi.nlm.nih.gov/4640638/
(24)
https://nap.nationalacademies.org/read/10490/chapter/1
(25)
https://apps.who.int/iris/handle/10665/41042
(26)
https://apps.who.int/iris/handle/10665/39527
(27)
https://apps.who.int/iris/handle/10665/43411
(28)
https://www.jbc.org/article/S0021-9258(18)56144-5/pdf
(29)
https://www.sciencedirect.com/science/article/abs/pii/000326977190474X
(30)
https://pubmed.ncbi.nlm.nih.gov/10953675/
(31)
https://pubmed.ncbi.nlm.nih.gov/12163671/
(32)
https://pubmed.ncbi.nlm.nih.gov/14814112/
(33)
https://pubmed.ncbi.nlm.nih.gov/14907749/
(34)
https://pubmed.ncbi.nlm.nih.gov/405858/
(35)
https://academic.oup.com/ajcn/article-abstract/30/6/887/4650319
(36)
https://academic.oup.com/jn/article/132/11/3340/4687349
(37)
https://pubmed.ncbi.nlm.nih.gov/7116644/
(38)
https://pubmed.ncbi.nlm.nih.gov/6491766/
(39)
https://academic.oup.com/ajcn/article-abstract/35/1/15/4693280?redirectedFrom=fulltext
(40)
https://agris.fao.org/agris-search/search.do?recordID=US19770222752
(41)
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4705437/
(42)
https://link.springer.com/article/10.1007/s00394-021-02790-y